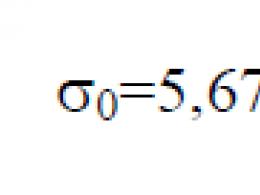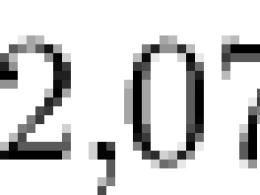Boltzmannova konstanta u jednadžbi Univerzalna plinska konstanta je univerzalna, fundamentalna fizička konstanta R, jednaka proizvodu Boltzmannove konstante k i Avogadrove konstante
Prema Stefan-Boltzmann zakonu, gustina integralnog hemisfernog zračenja E 0 zavisi samo od temperature i varira proporcionalno četvrtom stepenu apsolutne temperature T:
Stefan-Boltzmannova konstanta σ 0 je fizička konstanta uključena u zakon koji određuje zapreminsku gustinu ravnotežnog toplotnog zračenja apsolutno crnog tijela:

Istorijski gledano, Stefan-Boltzmann zakon je formulisan prije Planckovog zakona zračenja, iz čega proizlazi kao posljedica. Plankov zakon utvrđuje zavisnost spektralne gustine fluksa zračenja E 0 na talasnoj dužini λ i temperaturi T:

gdje je λ – talasna dužina, m; With=2.998 10 8 m/s – brzina svjetlosti u vakuumu; T– tjelesna temperatura, K;
h= 6,625 ×10 -34 J×s – Plankova konstanta.
Fizička konstanta k, jednak omjeru univerzalne plinske konstante R=8314J/(kg×K) na Avogadrov broj N / A.=6,022× 10 26 1/(kg×mol):
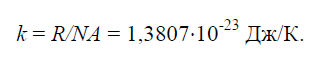
Broj različitih konfiguracija sistema od Nčestice za dati skup brojeva n i(broj čestica u i-stanje kojem odgovara energija e i) proporcionalno je vrijednosti:

Magnituda W postoji više načina distribucije Nčestice po energetskim nivoima. Ako je relacija (6) tačna, onda se smatra da se originalni sistem pridržava Boltzmannove statistike. Skup brojeva n i, na kojem je broj W maksimum, javlja se najčešće i odgovara najvjerovatnijoj distribuciji.
Fizička kinetika– mikroskopska teorija procesa u statistički neravnotežnim sistemima.
Opis velikog broja čestica može se uspješno provesti korištenjem probabilističkih metoda. Za jednoatomni plin, stanje skupa molekula određeno je njihovim koordinatama i vrijednostima projekcija brzina na odgovarajuće koordinatne osi. Matematički, ovo je opisano funkcijom distribucije, koja karakterizira vjerovatnoću da će čestica biti u datom stanju:

je očekivani broj molekula u zapremini d d čije su koordinate u rasponu od do +d, a čije su brzine u rasponu od do +d.
Ako se vremenski prosječna potencijalna energija interakcije molekula može zanemariti u usporedbi s njihovom kinetičkom energijom, tada se plin naziva idealnim. Idealan plin se naziva Boltzmannov plin ako je omjer slobodnog puta molekula u tom plinu i karakteristične veličine protoka L naravno, tj.

jer dužina putanje je obrnuto proporcionalna nd 2(n je numerička gustina 1/m 3, d je prečnik molekula, m).
Veličina
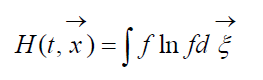
pozvao H-Boltzmannova funkcija za jediničnu zapreminu, koja je povezana sa verovatnoćom detekcije sistema molekula gasa u datom stanju. Svako stanje odgovara određenom broju popunjavanja šestodimenzionalnih ćelija prostorne brzine na koje se može podijeliti fazni prostor razmatranih molekula. Označimo W vjerovatnoća da će u prvoj ćeliji prostora koji se razmatra biti N 1 molekula, u drugoj N 2 itd.
Do konstante koja određuje porijeklo vjerovatnoće vrijedi sljedeća relacija:
 ,
,
Gdje 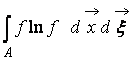 – H-funkcija područja prostora A okupirani gasom. Iz (9) je jasno da W I H međusobno povezani, tj. promjena vjerovatnoće stanja dovodi do odgovarajuće evolucije H funkcije.
– H-funkcija područja prostora A okupirani gasom. Iz (9) je jasno da W I H međusobno povezani, tj. promjena vjerovatnoće stanja dovodi do odgovarajuće evolucije H funkcije.

Boltzmanov princip uspostavlja vezu između entropije S fizički sistem i termodinamička vjerovatnoća W njene navode:

(objavljeno prema publikaciji: Kogan M.N. Dinamika razrijeđenog plina. - M.: Nauka, 1967.)
Opšti pogled na CUBE:

gdje je sila mase zbog prisustva različitih polja (gravitacijskih, električnih, magnetskih) koja djeluju na molekulu; J– integral sudara. Ovaj član Boltzmannove jednadžbe uzima u obzir sudare molekula međusobno i odgovarajuće promjene u brzinama čestica koje djeluju. Integral sudara je petodimenzionalni integral i ima sljedeću strukturu:

Jednačina (12) sa integralom (13) dobijena je za sudare molekula u kojima ne nastaju tangencijalne sile, tj. čestice koje se sudaraju smatraju se savršeno glatkim.
Tokom interakcije unutrašnja energija molekula se ne mijenja, tj. Pretpostavlja se da su ovi molekuli savršeno elastični. Razmatramo dvije grupe molekula koje imaju brzine i prije međusobnog sudara (sudar) (slika 1), a nakon sudara, respektivno, brzine i . Razlika u brzini naziva se relativna brzina, tj. . Jasno je da za glatki elastični sudar . Funkcije distribucije f 1 ", f", f 1 , f opisuju molekule odgovarajućih grupa nakon i prije sudara, tj. ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.

Rice. 1. Sudar dvaju molekula.
(13) uključuje dva parametra koji karakteriziraju lokaciju sudarajućih molekula u odnosu jedan prema drugom: b i ε; b– nišanska daljina, tj. najmanja udaljenost kojoj bi se molekuli približili u odsustvu interakcije (slika 2); ε se naziva kolizioni ugaoni parametar (slika 3). Integracija je završena b od 0 do ¥ i od 0 do 2p (dva vanjska integrala u (12)) pokriva cijelu ravan interakcije sila okomitu na vektor

Rice. 2. Putanja molekula.

Rice. 3. Razmatranje interakcije molekula u cilindričnom koordinatnom sistemu: z, b, ε
Boltzmannova kinetička jednačina je izvedena pod sljedećim pretpostavkama i pretpostavkama.
1. Smatra se da uglavnom dolazi do sudara dvaju molekula, tj. uloga sudara tri ili više molekula istovremeno je beznačajna. Ova pretpostavka nam omogućava da za analizu koristimo funkciju raspodjele jedne čestice, koja se gore jednostavno naziva funkcija distribucije. Uzimanje u obzir sudara tri molekula dovodi do potrebe da se u istraživanju koristi funkcija raspodjele s dvije čestice. Shodno tome, analiza postaje znatno komplikovanija.
2. Pretpostavka molekularnog haosa. Izražava se u činjenici da su vjerovatnoće detekcije čestice 1 u faznoj tački i čestice 2 u faznoj tački nezavisne jedna od druge.
3. Jednako su vjerovatni sudari molekula na bilo kojoj udaljenosti udara, tj. funkcija distribucije se ne mijenja na prečniku interakcije. Treba napomenuti da analizirani element mora biti mali tako da f unutar ovog elementa se ne mijenja, ali u isto vrijeme tako da relativna fluktuacija ~ nije velika. Interakcioni potencijali koji se koriste za izračunavanje integrala sudara su sferno simetrični, tj. ![]() .
.
Maxwell-Boltzmannova distribucija
Stanje ravnoteže gasa opisuje se apsolutnom Maksvelovskom raspodelom, koja je tačno rešenje Bolcmanove kinetičke jednačine:

gdje je m masa molekula, kg.
Opća lokalna Maxwellova distribucija, inače nazvana Maxwell-Boltzmannova distribucija:

u slučaju kada se gas kreće kao celina brzinom i varijable n, T zavise od koordinata
i vrijeme t.
U Zemljinom gravitacionom polju, tačno rešenje Bolcmanove jednačine pokazuje:

Gdje n 0 = gustina na površini Zemlje, 1/m3; g– ubrzanje gravitacije, m/s 2 ; h– visina, m. Formula (16) je tačno rješenje Boltzmannove kinetičke jednačine bilo u neograničenom prostoru ili u prisustvu granica koje ne narušavaju ovu raspodjelu, a temperatura također mora ostati konstantna.
Ovu stranicu je dizajnirao Puzina Yu.Yu. uz podršku Ruske fondacije za osnovna istraživanja - projekat br. 08-08-00638.
Među fundamentalnim konstantama, Boltzmannova konstanta k zauzima posebno mesto. M. Planck je još 1899. godine predložio sljedeće četiri numeričke konstante kao osnovne za konstrukciju jedinstvene fizike: brzinu svjetlosti c, kvant akcije h, gravitaciona konstanta G i Boltzmannova konstanta k. Među ovim konstantama, k zauzima posebno mjesto. On ne definiše elementarne fizičke procese i nije uključen u osnovne principe dinamike, ali uspostavlja vezu između mikroskopskih dinamičkih pojava i makroskopskih karakteristika stanja čestica. Takođe je uključen u osnovni zakon prirode koji povezuje entropiju sistema S sa termodinamičkom vjerovatnoćom njegovog stanja W:
S=klnW (Boltzmannova formula)
i određivanje pravca fizičkih procesa u prirodi. Posebnu pažnju treba obratiti na činjenicu da pojava Boltzmannove konstante u jednoj ili drugoj formuli klasične fizike svaki put jasno ukazuje na statističku prirodu fenomena koji opisuje. Razumijevanje fizičke suštine Boltzmannove konstante zahtijeva otkrivanje ogromnih slojeva fizike – statistike i termodinamike, teorije evolucije i kosmogonije.
Istraživanje L. Boltzmanna
Od 1866. radovi austrijskog teoretičara L. Boltzmanna objavljuju se jedan za drugim. U njima statistička teorija dobija tako čvrstu osnovu da se pretvara u pravu nauku o fizičkim svojstvima grupa čestica.
Raspodjelu je dobio Maxwell za najjednostavniji slučaj monoatomskog idealnog plina. Godine 1868. Boltzmann je pokazao da će poliatomski plinovi u stanju ravnoteže također biti opisani Maxwellovom raspodjelom.
Boltzmann u Clausiusovim djelima razvija ideju da se molekule plina ne mogu smatrati zasebnim materijalnim tačkama. Poliatomski molekuli također imaju rotaciju molekula kao cjeline i vibracije njegovih sastavnih atoma. On uvodi broj stupnjeva slobode molekula kao broj „promjenjivih potrebnih za određivanje položaja svih sastavnih dijelova molekula u prostoru i njihovog položaja jedan u odnosu na drugi“ i pokazuje da iz eksperimentalnih podataka o toplinskom kapacitetu gasova proizlazi da postoji ujednačena distribucija energije između različitih stupnjeva slobode. Svaki stepen slobode predstavlja istu energiju
Boltzmann je direktno povezao karakteristike mikrosvijeta sa karakteristikama makrosvijeta. Evo ključne formule koja uspostavlja ovaj odnos:
1/2 mv2 = kT
Gdje m I v- masa i prosječna brzina kretanja molekula plina, T- temperatura gasa (na apsolutnoj Kelvinovoj skali), i k- Boltzmannova konstanta. Ova jednačina premošćuje jaz između dva svijeta, povezujući svojstva atomskog nivoa (na lijevoj strani) sa svojstvima mase (na desnoj strani) koja se mogu mjeriti pomoću ljudskih instrumenata, u ovom slučaju termometara. Ovaj odnos obezbeđuje Boltzmannova konstanta k, jednaka 1,38 x 10-23 J/K.
Završavajući razgovor o Boltzmannovoj konstanti, želio bih još jednom naglasiti njen fundamentalni značaj u nauci. Sadrži ogromne slojeve fizike - atomizam i molekularno-kinetičku teoriju strukture materije, statističku teoriju i suštinu toplotnih procesa. Proučavanje ireverzibilnosti termičkih procesa otkrilo je prirodu fizičke evolucije, koncentriranu u Boltzmannovoj formuli S=klnW. Treba naglasiti da pozicija prema kojoj će zatvoreni sistem prije ili kasnije doći u stanje termodinamičke ravnoteže vrijedi samo za izolovane sisteme i sisteme u stacionarnim vanjskim uvjetima. U našem univerzumu se kontinuirano odvijaju procesi čiji je rezultat promjena njegovih prostornih svojstava. Nestacionarnost Univerzuma neizbežno dovodi do odsustva statističke ravnoteže u njemu.
(k ili k B) je fizička konstanta koja definira odnos između temperature i energije. Ime je dobio po austrijskom fizičaru Ludwigu Boltzmannu, koji je dao veliki doprinos statističkoj fizici, u kojoj je ovo postalo ključno mjesto. Njegova eksperimentalna vrijednost u SI sistemu jeBrojevi u zagradama označavaju standardnu grešku u posljednjim znamenkama vrijednosti količine. U principu, Boltzmannova konstanta se može dobiti iz definicije apsolutne temperature i drugih fizičkih konstanti (da biste to učinili, morate biti u stanju izračunati temperaturu trostruke tačke vode iz prvih principa). Ali određivanje Boltzmannove konstante korištenjem prvih principa je previše složeno i nerealno s trenutnim razvojem znanja u ovoj oblasti.
Boltzmannova konstanta je redundantna fizička konstanta ako temperaturu mjerite u jedinicama energije, što se vrlo često radi u fizici. To je, u stvari, veza između dobro definisane veličine – energije i stepena, čije se značenje istorijski razvijalo.
Definicija entropije
Entropija termodinamičkog sistema je definisana kao prirodni logaritam broja različitih mikrostanja Z koja odgovaraju datom makroskopskom stanju (na primer, stanja sa datom ukupnom energijom).
Faktor proporcionalnosti k i je Boltzmanova konstanta. Ovaj izraz, koji definira odnos između mikroskopskih (Z) i makroskopskih (S) karakteristika, izražava glavnu (centralnu) ideju statističke mehanike.
Rođen 1844. godine u Beču. Boltzmann je pionir i pionir nauke. Njegovi radovi i istraživanja često su bili nerazumljivi i odbačeni od strane društva. Međutim, daljim razvojem fizike, njegovi radovi su prepoznati i naknadno objavljeni.
Naučna interesovanja naučnika pokrivala su fundamentalna područja kao što su fizika i matematika. Od 1867. godine radio je kao nastavnik u nizu visokoškolskih ustanova. U svom istraživanju je ustanovio da je to zbog haotičnih udara molekula na zidove posude u kojoj se nalaze, dok temperatura direktno zavisi od brzine kretanja čestica (molekula), odnosno od njihove Stoga, što se ove čestice kreću većom brzinom, to je viša temperatura. Boltzmanova konstanta je dobila ime po poznatom austrijskom naučniku. Upravo je on dao neprocjenjiv doprinos razvoju statičke fizike.
Fizičko značenje ove konstantne količine
Boltzmannova konstanta definira odnos između temperature i energije. U statičkoj mehanici igra glavnu ključnu ulogu. Boltzmanova konstanta je k=1,3806505(24)*10 -23 J/K. Brojevi u zagradama označavaju dozvoljenu grešku vrijednosti u odnosu na posljednje cifre. Vrijedi napomenuti da se Boltzmannova konstanta može izvesti i iz drugih fizičkih konstanti. Međutim, ovi proračuni su prilično složeni i teško ih je izvesti. Oni zahtijevaju duboko znanje ne samo iz oblasti fizike, već i
Boltzmanova konstanta gradi most od makrokosmosa do mikrokosmosa, povezujući temperaturu sa kinetičkom energijom molekula.
Ludwig Boltzmann jedan je od tvoraca molekularno-kinetičke teorije plinova, na kojoj se savremena slika odnosa između kretanja atoma i molekula, s jedne strane, i makroskopskih svojstava materije, kao što su temperatura i pritisak, na drugi je zasnovan. Na ovoj slici pritisak gasa je određen elastičnim udarima molekula gasa na zidove posude, a temperatura je određena brzinom kretanja molekula (tačnije, njihovom kinetičkom energijom). Što se molekuli brže kreću, to je viša temperatura.
Boltzmanova konstanta omogućava da se karakteristike mikrosvijeta direktno povežu sa karakteristikama makrosvijeta – posebno s očitanjima termometra. Evo ključne formule koja uspostavlja ovaj odnos:
1/2 mv 2 = kT
Gdje m I v— odnosno, masa i prosječna brzina molekula plina, T je temperatura gasa (na apsolutnoj Kelvinovoj skali), i k — Boltzmannova konstanta. Ova jednačina premošćuje jaz između dva svijeta, povezujući karakteristike atomskog nivoa (na lijevoj strani) sa volumetrijska svojstva(na desnoj strani), što se može mjeriti ljudskim instrumentima, u ovom slučaju termometrima. Ovu vezu osigurava Boltzmannova konstanta k, jednako 1,38 x 10 -23 J/K.
Grana fizike koja proučava veze između fenomena mikrosvijeta i makrosvijeta naziva se statistička mehanika. Teško da postoji jednačina ili formula u ovom odeljku koja ne uključuje Boltzmanovu konstantu. Jednu od ovih veza izveo je sam Austrijanac, i jednostavno se zove Boltzmannova jednadžba:
S = k log str + b
Gdje S— entropija sistema ( cm. Drugi zakon termodinamike) str- takozvani statistička težina(veoma važan element statističkog pristupa), i b- još jedna konstanta.
Tokom svog života, Ludwig Boltzmann je doslovno bio ispred svog vremena, razvijajući temelje moderne atomske teorije strukture materije, ulazeći u žestoke sporove sa ogromnom konzervativnom većinom naučne zajednice svog vremena, koja je atome smatrala samo konvencijom. , pogodan za proračune, ali ne i objekti stvarnog svijeta. Kada njegov statistički pristup nije naišao na ni najmanje razumijevanje ni nakon pojave specijalne teorije relativnosti, Boltzmann je izvršio samoubistvo u trenutku duboke depresije. Boltzmanova jednačina je uklesana na njegovom nadgrobnom spomeniku.
Boltzmann, 1844-1906
austrijski fizičar. Rođen u Beču u porodici državnog službenika. Studirao na Univerzitetu u Beču na istom kursu sa Josefom Stefanom ( cm. Stefan-Boltzmannov zakon). Odbranivši diplomu 1866. godine, nastavio je svoju naučnu karijeru, držeći u različito vrijeme profesore na odsjecima za fiziku i matematiku na univerzitetima u Gracu, Beču, Minhenu i Lajpcigu. Kao jedan od glavnih zagovornika realnosti postojanja atoma, napravio je niz izvanrednih teorijskih otkrića koja bacaju svjetlo na to kako pojave na atomskom nivou utječu na fizička svojstva i ponašanje materije.