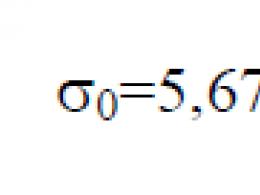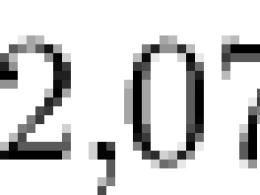Fizičko značenje Boltzmannove konstante. Ludwig Boltzmann: Lična dostignuća
Brojevi u zagradama označavaju standardnu grešku u posljednjim znamenkama vrijednosti količine. U principu, Boltzmannova konstanta se može dobiti iz definicije apsolutne temperature i drugih fizičkih konstanti (da biste to učinili, morate biti u stanju izračunati temperaturu trostruke tačke vode iz prvih principa). Ali određivanje Boltzmannove konstante korištenjem prvih principa je previše složeno i nerealno s trenutnim razvojem znanja u ovoj oblasti.
Boltzmannova konstanta je redundantna fizička konstanta ako temperaturu mjerite u jedinicama energije, što se vrlo često radi u fizici. To je, u stvari, veza između dobro definisane veličine – energije i stepena, čije se značenje istorijski razvijalo.
Definicija entropije
Entropija termodinamičkog sistema je definisana kao prirodni logaritam broja različitih mikrostanja Z koja odgovaraju datom makroskopskom stanju (na primer, stanja sa datom ukupnom energijom).
Faktor proporcionalnosti k i je Boltzmanova konstanta. Ovaj izraz, koji definira odnos između mikroskopskih (Z) i makroskopskih (S) karakteristika, izražava glavnu (centralnu) ideju statističke mehanike.
Ime je dobio po austrijskom fizičaru Ludwigu Boltzmannu, koji je dao veliki doprinos statističkoj fizici, u kojoj ova konstanta igra ključnu ulogu. Njegova eksperimentalna vrijednost u SI sistemu je
J/.Brojevi u zagradama označavaju standardnu grešku u posljednjim znamenkama vrijednosti količine. U principu, Boltzmannova konstanta se može dobiti iz definicije apsolutne temperature i drugih fizičkih konstanti. Međutim, izračunavanje Boltzmannove konstante koristeći prve principe je previše složeno i neizvodljivo s trenutnim stanjem znanja. U prirodnom sistemu Planckovih jedinica, prirodna jedinica temperature je data tako da je Boltzmanova konstanta jednaka jedinici.
Odnos između temperature i energije
U homogenom idealnom gasu na apsolutnoj temperaturi T, energija po svakom translacionom stepenu slobode je jednaka, kao što sledi iz Maksvelove raspodele kT/ 2 . Na sobnoj temperaturi (300°C) ova energija je ![]() J, ili 0,013 eV. U monoatomskom idealnom gasu, svaki atom ima tri stepena slobode koji odgovaraju tri prostorne ose, što znači da svaki atom ima energiju 3/2( kT)
.
J, ili 0,013 eV. U monoatomskom idealnom gasu, svaki atom ima tri stepena slobode koji odgovaraju tri prostorne ose, što znači da svaki atom ima energiju 3/2( kT)
.
Poznavajući toplotnu energiju, možemo izračunati srednju kvadratnu brzinu atoma, koja je obrnuto proporcionalna kvadratnom korijenu atomske mase. Srednja kvadratna brzina na sobnoj temperaturi varira od 1370 m/s za helijum do 240 m/s za ksenon. U slučaju molekularnog plina situacija postaje složenija, na primjer dvoatomski plin već ima približno pet stupnjeva slobode.
Definicija entropije
Entropija termodinamičkog sistema je definisana kao prirodni logaritam broja različitih mikrostanja Z, koji odgovara datom makroskopskom stanju (na primjer, stanju sa datom ukupnom energijom).
S = k ln Z.Faktor proporcionalnosti k i je Boltzmanova konstanta. Ovo je izraz koji definira odnos između mikroskopskih ( Z) i makroskopska stanja ( S), izražava središnju ideju statističke mehanike.
vidi takođe
Wikimedia Foundation. 2010.
Pogledajte šta je “Boltzmannova konstanta” u drugim rječnicima:
Fizička konstanta k, jednaka omjeru univerzalne plinske konstante R i Avogadrovog broja NA: k = R/NA = 1,3807,10 23 J/K. Nazvan po L. Boltzmannu... Veliki enciklopedijski rječnik
Jedna od osnovnih fizičkih konstanti; jednak omjeru plinske konstante R i Avogadro konstante NA, označene sa k; nazvan po austrijskom fizičar L. Boltzmann. Bp je uključen u niz najvažnijih odnosa fizike: u jednadžbi ... ... Fizička enciklopedija
BOLZMANN CONSTANT- (k) univerzalni fizički. konstanta jednaka omjeru univerzalnog plina (vidi) i Avogadro konstante NA: k = R/Na = (1,380658 ± 000012)∙10 23 J/K ... Velika politehnička enciklopedija
Fizička konstanta k, jednaka omjeru univerzalne plinske konstante R i Avogadrovog broja NA: k = R/NA = 1,3807·10 23 J/K. Nazvan po L. Boltzmannu. * * * BOLTZMANNOVA KONSTANTA BOLTZMANNOVA KONSTANTA, fizička konstanta k, jednaka ... ... enciklopedijski rječnik
Phys. konstanta k, jednaka omjeru univerzalne. gasna konstanta R prema Avogadrovom broju NA: k = R/NA = 1,3807 x 10 23 J/K. Nazvan po L. Boltzmannu... Prirodna nauka. enciklopedijski rječnik
Jedna od osnovnih fizičkih konstanti (vidi Fizičke konstante), jednaka omjeru univerzalne plinske konstante R i Avogadrovog broja NA. (broj molekula u 1 molu ili 1 kmolu supstance): k = R/NA. Nazvan po L. Boltzmannu. B. p...... Velika sovjetska enciklopedija
Rođen 1844. godine u Beču. Boltzmann je pionir i pionir nauke. Njegovi radovi i istraživanja često su bili nerazumljivi i odbačeni od strane društva. Međutim, daljim razvojem fizike, njegovi radovi su prepoznati i naknadno objavljeni.
Naučna interesovanja naučnika pokrivala su fundamentalna područja kao što su fizika i matematika. Od 1867. godine radio je kao nastavnik u nizu visokoškolskih ustanova. U svom istraživanju je ustanovio da je to zbog haotičnih udara molekula na zidove posude u kojoj se nalaze, dok temperatura direktno zavisi od brzine kretanja čestica (molekula), odnosno od njihove Stoga, što se ove čestice kreću većom brzinom, to je viša temperatura. Boltzmanova konstanta je dobila ime po poznatom austrijskom naučniku. Upravo je on dao neprocjenjiv doprinos razvoju statičke fizike.
Fizičko značenje ove konstantne količine
Boltzmannova konstanta definira odnos između temperature i energije. U statičkoj mehanici igra glavnu ključnu ulogu. Boltzmanova konstanta je k=1,3806505(24)*10 -23 J/K. Brojevi u zagradama označavaju dozvoljenu grešku vrijednosti u odnosu na posljednje cifre. Vrijedi napomenuti da se Boltzmannova konstanta može izvesti i iz drugih fizičkih konstanti. Međutim, ovi proračuni su prilično složeni i teško ih je izvesti. Oni zahtijevaju duboko znanje ne samo iz oblasti fizike, već i
Boltzmannova konstanta (k (\displaystyle k) ili k B (\displaystyle k_(\rm (B)))) - fizička konstanta koja određuje odnos između temperature i energije. Ime je dobio po austrijskom fizičaru Ludwigu Boltzmannu, koji je dao veliki doprinos statističkoj fizici, u kojoj ova konstanta igra ključnu ulogu. Njegova eksperimentalna vrijednost u Međunarodnom sistemu jedinica (SI) je:
k = 1.380 648 52 (79) × 10 − 23 (\displaystyle k=1(,)380\,648\,52(79)\puta 10^(-23)) J/.Brojevi u zagradama označavaju standardnu grešku u posljednjim znamenkama vrijednosti količine.
Enciklopedijski YouTube
1 / 3
✪ Toplotno zračenje. Stefan-Boltzmannov zakon
✪ Boltzmannov model distribucije.
✪ Fizika. MKT: Mendeljejev-Klapejronova jednačina za idealni gas. Foxford Online Learning Center
Titlovi
Odnos između temperature i energije
U homogenom idealnom gasu na apsolutnoj temperaturi T (\displaystyle T), energija po svakom translacionom stepenu slobode je jednaka, kao što sledi iz Maksvelove raspodele, k T / 2 (\displaystyle kT/2). Na sobnoj temperaturi (300°C) ova energija je 2 , 07 × 10 − 21 (\displaystyle 2(,)07\puta 10^(-21)) J, ili 0,013 eV. U monoatomskom idealnom gasu, svaki atom ima tri stepena slobode koji odgovaraju tri prostorne ose, što znači da svaki atom ima energiju od 3 2 k T (\displaystyle (\frac (3)(2))kT).
Poznavajući toplotnu energiju, možemo izračunati srednju kvadratnu brzinu atoma, koja je obrnuto proporcionalna kvadratnom korijenu atomske mase. Srednja kvadratna brzina na sobnoj temperaturi varira od 1370 m/s za helijum do 240 m/s za ksenon. U slučaju molekularnog plina, situacija postaje složenija, na primjer, dvoatomski plin ima pet stupnjeva slobode (na niskim temperaturama, kada se ne pobuđuju vibracije atoma u molekuli).
Definicija entropije
Entropija termodinamičkog sistema je definisana kao prirodni logaritam broja različitih mikrostanja Z (\displaystyle Z), koji odgovara datom makroskopskom stanju (na primjer, stanju sa datom ukupnom energijom).
S = k ln Z . (\displaystyle S=k\ln Z.)Faktor proporcionalnosti k (\displaystyle k) i je Boltzmanova konstanta. Ovo je izraz koji definira odnos između mikroskopskih ( Z (\displaystyle Z)) i makroskopska stanja ( S (\displaystyle S)), izražava središnju ideju statističke mehanike.
Fiksiranje pretpostavljene vrijednosti
XXIV Generalna konferencija o utezima i mjerama, održana 17-21. oktobra 2011. godine, usvojila je rezoluciju u kojoj je, posebno, predloženo da se buduća revizija Međunarodnog sistema jedinica izvrši na način da se fiksirati vrijednost Boltzmannove konstante, nakon čega će se smatrati određenom upravo. Kao rezultat toga, bit će izvršeno tačno jednakost k=1,380 6X⋅10 −23 J/K, gdje X predstavlja jednu ili više značajnih cifara, koje će se dalje odrediti na osnovu najtačnijih preporuka CODATA. Ova navodna fiksacija povezana je sa željom da se redefinira jedinica termodinamičke temperature kelvin, povezujući njenu vrijednost sa vrijednošću Boltzmannove konstante.
Boltzmannova konstanta (k (\displaystyle k) ili k B (\displaystyle k_(\rm (B)))) - fizička konstanta koja definira odnos između temperature i energije. Ime je dobio po austrijskom fizičaru Ludwigu Boltzmannu, koji je dao veliki doprinos statističkoj fizici, u kojoj ova konstanta igra ključnu ulogu. Njegova vrijednost u Međunarodnom sistemu jedinica SI prema promjenama u definicijama osnovnih SI jedinica (2018) potpuno je jednaka
k = 1.380 649 × 10 − 23 (\displaystyle k=1(,)380\,649\puta 10^(-23)) J/.Odnos između temperature i energije
U homogenom idealnom gasu na apsolutnoj temperaturi T (\displaystyle T), energija po svakom translacionom stepenu slobode je jednaka, kao što sledi iz Maksvelove raspodele, k T / 2 (\displaystyle kT/2). Na sobnoj temperaturi (300°C) ova energija je 2 , 07 × 10 − 21 (\displaystyle 2(,)07\puta 10^(-21)) J, ili 0,013 eV. U monoatomskom idealnom gasu, svaki atom ima tri stepena slobode koji odgovaraju tri prostorne ose, što znači da svaki atom ima energiju od 3 2 k T (\displaystyle (\frac (3)(2))kT).
Poznavajući toplotnu energiju, možemo izračunati srednju kvadratnu brzinu atoma, koja je obrnuto proporcionalna kvadratnom korijenu atomske mase. Srednja kvadratna brzina na sobnoj temperaturi varira od 1370 m/s za helijum do 240 m/s za ksenon. U slučaju molekularnog plina situacija postaje složenija, na primjer, dvoatomski plin ima 5 stupnjeva slobode - 3 translacijska i 2 rotirajuća (na niskim temperaturama, kada se ne pobuđuju vibracije atoma u molekuli i dodatni stupnjevi sloboda se ne dodaju).
Definicija entropije
Entropija termodinamičkog sistema je definisana kao prirodni logaritam broja različitih mikrostanja Z (\displaystyle Z), koji odgovara datom makroskopskom stanju (na primjer, stanju sa datom ukupnom energijom).
S = k ln Z . (\displaystyle S=k\ln Z.)Faktor proporcionalnosti k (\displaystyle k) i je Boltzmanova konstanta. Ovo je izraz koji definira odnos između mikroskopskih ( Z (\displaystyle Z)) i makroskopska stanja ( S (\displaystyle S)), izražava središnju ideju statističke mehanike.