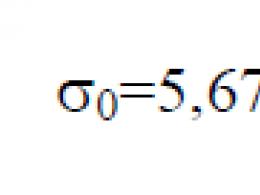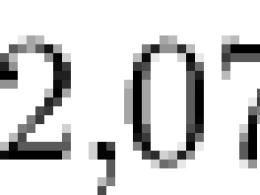La costante di Boltzmann nell'Eq. La costante universale dei gas è una costante fisica universale e fondamentale R, pari al prodotto della costante di Boltzmann k e della costante di Avogadro
Secondo la legge di Stefan-Boltzmann, la densità della radiazione emisferica integrale E0 dipende solo dalla temperatura e varia proporzionalmente alla quarta potenza della temperatura assoluta T:
La costante di Stefan–Boltzmann σ 0 è una costante fisica inclusa nella legge che determina la densità volumetrica della radiazione termica di equilibrio di un corpo assolutamente nero:

Storicamente la legge di Stefan-Boltzmann è stata formulata prima della legge sulla radiazione di Planck, dalla quale discende di conseguenza. La legge di Planck stabilisce la dipendenza dalla densità del flusso spettrale della radiazione E 0 sulla lunghezza d'onda λ e sulla temperatura T:

dove λ – lunghezza d'onda, m; Con=2.998 10 8 m/s – velocità della luce nel vuoto; T– temperatura corporea, K;
H= 6.625 ×10 -34 J×s – Costante di Planck.
Costante fisica K, pari al rapporto della costante universale dei gas R=8314J/(kg×K) al numero di Avogadro N / A.=6,022× 10 26 1/(kg×mol):
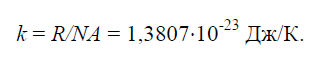
Numero di diverse configurazioni di sistema da N particelle per un dato insieme di numeri no io(numero di particelle in io-lo stato a cui corrisponde l'energia e i) è proporzionale al valore:

Grandezza W ci sono diversi modi di distribuzione N particelle per livelli energetici. Se la relazione (6) è vera, allora si considera che il sistema originale obbedisca alla statistica di Boltzmann. Insieme di numeri no io, in cui il numero W massimo, si verifica più frequentemente e corrisponde alla distribuzione più probabile.
Cinetica fisica– teoria microscopica dei processi in sistemi statisticamente non in equilibrio.
La descrizione di un gran numero di particelle può essere effettuata con successo utilizzando metodi probabilistici. Per un gas monoatomico, lo stato di un insieme di molecole è determinato dalle loro coordinate e dai valori delle proiezioni di velocità sui corrispondenti assi delle coordinate. Matematicamente, questo è descritto dalla funzione di distribuzione, che caratterizza la probabilità che una particella si trovi in un dato stato:

è il numero atteso di molecole in un volume d d le cui coordinate sono nell'intervallo da a +d e le cui velocità sono nell'intervallo da a +d.
Se l'energia potenziale mediata nel tempo di interazione delle molecole può essere trascurata rispetto alla loro energia cinetica, allora il gas viene chiamato ideale. Un gas ideale è chiamato gas Boltzmann se il rapporto tra la lunghezza del percorso delle molecole in questo gas e la dimensione caratteristica del flusso l ovviamente, cioè

Perché la lunghezza del percorso è inversamente proporzionale secondo 2(n è la densità numerica 1/m 3, d è il diametro della molecola, m).
Misurare
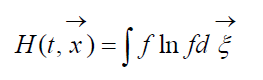
chiamato H-Funzione di Boltzmann per un'unità di volume, che è associata alla probabilità di rilevare un sistema di molecole di gas in un dato stato. Ogni stato corrisponde a un certo numero di celle di velocità spaziale esadimensionali di riempimento in cui può essere suddiviso lo spazio delle fasi delle molecole considerate. Denotiamo W la probabilità che ci siano N 1 molecole nella prima cella dello spazio considerato, N 2 nella seconda, ecc.
A meno di una costante che determina l'origine della probabilità, vale la seguente relazione:
 ,
,
Dove 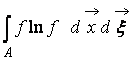 – Funzione H di una regione dello spazio UN occupato dal gas. Dalla (9) è chiaro che W E H interconnessi, cioè un cambiamento nella probabilità di uno stato porta ad una corrispondente evoluzione della funzione H.
– Funzione H di una regione dello spazio UN occupato dal gas. Dalla (9) è chiaro che W E H interconnessi, cioè un cambiamento nella probabilità di uno stato porta ad una corrispondente evoluzione della funzione H.

Il principio di Boltzmann stabilisce la connessione tra entropia S sistema fisico e probabilità termodinamica W lei afferma:

(pubblicato secondo la pubblicazione: Kogan M.N. Dinamica di un gas rarefatto. - M.: Nauka, 1967.)
Vista generale del CUBO:

dove è la forza di massa dovuta alla presenza dei vari campi (gravitazionali, elettrici, magnetici) che agiscono sulla molecola; J– integrale di collisione. È questo termine dell'equazione di Boltzmann che tiene conto delle collisioni delle molecole tra loro e dei corrispondenti cambiamenti nella velocità delle particelle interagenti. L'integrale di collisione è un integrale pentadimensionale e ha la seguente struttura:

L'equazione (12) con l'integrale (13) è stata ottenuta per collisioni di molecole in cui non si verificano forze tangenziali, cioè le particelle in collisione sono considerate perfettamente lisce.
Durante l'interazione, l'energia interna delle molecole non cambia, cioè si presuppone che queste molecole siano perfettamente elastiche. Vengono considerati due gruppi di molecole, aventi velocità e prima di scontrarsi tra loro (collisione), e dopo la collisione, rispettivamente, velocità e . La differenza di velocità è chiamata velocità relativa, cioè . È chiaro che per una collisione elastica regolare . Funzioni di distribuzione f1", f", f1, f descrivi le molecole dei gruppi corrispondenti dopo e prima delle collisioni, cioè ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.

Riso. 1. Collisione di due molecole.
(13) include due parametri che caratterizzano la posizione delle molecole in collisione l'una rispetto all'altra: B e ε; B– distanza di mira, cioè la distanza più piccola alla quale le molecole si avvicinerebbero in assenza di interazione (Fig. 2); ε è chiamato parametro angolare di collisione (Fig. 3). Integrazione finita B da 0 a ¥ e da 0 a 2p (due integrali esterni nella (12)) copre l'intero piano di interazione delle forze perpendicolare al vettore

Riso. 2. La traiettoria delle molecole.

Riso. 3. Considerazione dell'interazione delle molecole in un sistema di coordinate cilindriche: z, B, ε
L'equazione cinetica di Boltzmann è derivata dalle seguenti ipotesi e ipotesi.
1. Si ritiene che si verifichino principalmente collisioni di due molecole, ad es. il ruolo delle collisioni di tre o più molecole contemporaneamente è insignificante. Questo presupposto ci consente di utilizzare per l'analisi una funzione di distribuzione di particella singola, che sopra è semplicemente chiamata funzione di distribuzione. Prendere in considerazione la collisione di tre molecole porta alla necessità di utilizzare nello studio una funzione di distribuzione a due particelle. Di conseguenza, l’analisi diventa notevolmente più complicata.
2. Presupposto del caos molecolare. Si esprime nel fatto che le probabilità di rilevare la particella 1 nel punto di fase e la particella 2 nel punto di fase sono indipendenti l'una dall'altra.
3. Le collisioni di molecole con qualsiasi distanza di impatto sono ugualmente probabili, ad es. la funzione di distribuzione non cambia al diametro di interazione. Va notato che l'elemento analizzato deve essere piccolo in modo che F all'interno di questo elemento non cambia, ma allo stesso tempo in modo che la fluttuazione relativa ~ non sia grande. I potenziali di interazione utilizzati nel calcolo dell'integrale di collisione sono sfericamente simmetrici, cioè ![]() .
.
Distribuzione di Maxwell-Boltzmann
Lo stato di equilibrio del gas è descritto dalla distribuzione Maxwelliana assoluta, che è una soluzione esatta dell'equazione cinetica di Boltzmann:

dove m è la massa della molecola, kg.
La distribuzione Maxwelliana locale generale, altrimenti chiamata distribuzione Maxwell-Boltzmann:

nel caso in cui il gas si muove complessivamente con velocità e le variabili n, T dipendono dalla coordinata
e il tempo t.
Nel campo gravitazionale della Terra, la soluzione esatta dell'equazione di Boltzmann mostra:

Dove N 0 = densità sulla superficie terrestre, 1/m3; G– accelerazione di gravità, m/s 2 ; H– altezza, m La formula (16) è una soluzione esatta dell'equazione cinetica di Boltzmann sia nello spazio illimitato sia in presenza di confini che non violano questa distribuzione, mentre anche la temperatura deve rimanere costante.
Questa pagina è stata progettata da Puzina Yu.Yu. con il sostegno della Fondazione russa per la ricerca di base - progetto n. 08-08-00638.
Tra le costanti fondamentali, la costante di Boltzmann K occupa un posto speciale. Già nel 1899, M. Planck propose le seguenti quattro costanti numeriche come fondamentali per la costruzione della fisica unificata: la velocità della luce C, quanto d'azione H, costante gravitazionale G e costante di Boltzmann K. Tra queste costanti, k occupa un posto speciale. Non definisce i processi fisici elementari e non è compreso nei principi fondamentali della dinamica, ma stabilisce una connessione tra fenomeni dinamici microscopici e caratteristiche macroscopiche dello stato delle particelle. È anche incluso nella legge fondamentale della natura che mette in relazione l'entropia del sistema S con la probabilità termodinamica del suo stato W:
S=klnW (formula di Boltzmann)
e determinare la direzione dei processi fisici in natura. Particolare attenzione dovrebbe essere prestata al fatto che l'apparizione della costante di Boltzmann in una o nell'altra formula della fisica classica indica ogni volta chiaramente la natura statistica del fenomeno che descrive. Comprendere l'essenza fisica della costante di Boltzmann richiede la scoperta di enormi strati di fisica: statistica e termodinamica, teoria dell'evoluzione e cosmogonia.
Ricerca di L. Boltzmann
Dal 1866 vengono pubblicate una dopo l'altra le opere del teorico austriaco L. Boltzmann. In essi, la teoria statistica riceve basi così solide da trasformarsi in una vera scienza sulle proprietà fisiche dei gruppi di particelle.
La distribuzione è stata ottenuta da Maxwell per il caso più semplice di gas ideale monoatomico. Nel 1868 Boltzmann dimostrò che anche i gas poliatomici in uno stato di equilibrio possono essere descritti dalla distribuzione di Maxwell.
Boltzmann sviluppa nelle opere di Clausius l'idea che le molecole di gas non possono essere considerate come punti materiali separati. Le molecole poliatomiche hanno anche la rotazione della molecola nel suo insieme e le vibrazioni dei suoi atomi costituenti. Introduce il numero di gradi di libertà delle molecole come il numero di “variabili necessarie per determinare la posizione di tutte le parti costituenti di una molecola nello spazio e la loro posizione relativa l'una rispetto all'altra” e mostra che, partendo dai dati sperimentali sulla capacità termica delle molecole gas ne consegue che esiste una distribuzione uniforme dell'energia tra i vari gradi di libertà. Ogni grado di libertà rappresenta la stessa energia
Boltzmann collegò direttamente le caratteristiche del micromondo con le caratteristiche del macromondo. Ecco la formula chiave che stabilisce questa relazione:
1/2 mv2 = kT
Dove M E v- rispettivamente, la massa e la velocità media di movimento delle molecole di gas, T- temperatura del gas (sulla scala assoluta Kelvin), e K- Costante di Boltzmann. Questa equazione colma il divario tra i due mondi, collegando le proprietà a livello atomico (a sinistra) con le proprietà di massa (a destra) che possono essere misurate utilizzando strumenti umani, in questo caso i termometri. Questa relazione è fornita dalla costante di Boltzmann k, pari a 1,38 x 10-23 J/K.
Concludendo la conversazione sulla costante di Boltzmann, vorrei sottolineare ancora una volta la sua fondamentale importanza nella scienza. Contiene enormi strati di fisica: atomismo e teoria cinetica molecolare della struttura della materia, teoria statistica e l'essenza dei processi termici. Lo studio dell'irreversibilità dei processi termici ha rivelato la natura dell'evoluzione fisica, concentrata nella formula di Boltzmann S=klnW. Va sottolineato che la posizione secondo cui un sistema chiuso raggiunge prima o poi uno stato di equilibrio termodinamico è valida solo per sistemi isolati e sistemi in condizioni esterne stazionarie. Nel nostro Universo si verificano continuamente processi, il cui risultato è un cambiamento nelle sue proprietà spaziali. La non stazionarietà dell'Universo porta inevitabilmente all'assenza di equilibrio statistico in esso.
(K O kB)è una costante fisica che definisce la relazione tra temperatura ed energia. Prende il nome dal fisico austriaco Ludwig Boltzmann, che diede importanti contributi alla fisica statistica, nella quale questa divenne una posizione chiave. Il suo valore sperimentale nel sistema SI èI numeri tra parentesi indicano l'errore standard nelle ultime cifre del valore della quantità. In linea di principio, la costante di Boltzmann può essere ottenuta dalla definizione di temperatura assoluta e di altre costanti fisiche (per fare ciò è necessario saper calcolare la temperatura del punto triplo dell'acqua dai principi primi). Ma determinare la costante di Boltzmann utilizzando i principi primi è troppo complesso e irrealistico con l’attuale sviluppo delle conoscenze in questo campo.
La costante di Boltzmann è una costante fisica ridondante se si misura la temperatura in unità di energia, cosa che viene fatta molto spesso in fisica. Si tratta, infatti, di una connessione tra una quantità ben definita - energia e grado, il cui significato si è sviluppato storicamente.
Definizione di entropia
L'entropia di un sistema termodinamico è definita come il logaritmo naturale del numero di diversi microstati Z corrispondenti a un dato stato macroscopico (ad esempio, stati con una data energia totale).
Fattore di proporzionalità K ed è la costante di Boltzmann. Questa espressione, che definisce la relazione tra caratteristiche microscopiche (Z) e macroscopiche (S), esprime l'idea principale (centrale) della meccanica statistica.
Nato nel 1844 a Vienna. Boltzmann è un pioniere e pioniere della scienza. Le sue opere e le sue ricerche erano spesso incomprensibili e rifiutate dalla società. Tuttavia, con l'ulteriore sviluppo della fisica, i suoi lavori furono riconosciuti e successivamente pubblicati.
Gli interessi scientifici dello scienziato coprivano aree fondamentali come la fisica e la matematica. Dal 1867 lavorò come insegnante in numerosi istituti di istruzione superiore. Nella sua ricerca, ha stabilito che ciò è dovuto agli impatti caotici delle molecole sulle pareti del recipiente in cui si trovano, mentre la temperatura dipende direttamente dalla velocità di movimento delle particelle (molecole), in altre parole, dalla loro Pertanto, maggiore è la velocità di movimento di queste particelle, maggiore è la temperatura. La costante di Boltzmann prende il nome dal famoso scienziato austriaco. Fu lui a dare un contributo inestimabile allo sviluppo della fisica statica.
Significato fisico di questa grandezza costante
La costante di Boltzmann definisce la relazione tra temperatura ed energia. Nella meccanica statica svolge un ruolo chiave. La costante di Boltzmann è pari a k=1,3806505(24)*10 -23 J/K. I numeri tra parentesi indicano l'errore consentito del valore rispetto alle ultime cifre. Vale la pena notare che la costante di Boltzmann può essere derivata anche da altre costanti fisiche. Tuttavia, questi calcoli sono piuttosto complessi e difficili da eseguire. Richiedono una conoscenza approfondita non solo nel campo della fisica, ma anche
La costante di Boltzmann costruisce un ponte dal macrocosmo al microcosmo, collegando la temperatura con l'energia cinetica delle molecole.
Ludwig Boltzmann è uno dei creatori della teoria cinetica molecolare dei gas, sulla quale si basa il quadro moderno della relazione tra il movimento degli atomi e delle molecole, da un lato, e le proprietà macroscopiche della materia, come la temperatura e la pressione, dall'altro. l'altro, è basato. In questa immagine, la pressione del gas è determinata dagli impatti elastici delle molecole di gas sulle pareti del recipiente, e la temperatura è determinata dalla velocità di movimento delle molecole (o meglio, dalla loro energia cinetica). più alta è la temperatura.
La costante di Boltzmann consente di mettere in relazione direttamente le caratteristiche del micromondo con le caratteristiche del macromondo, in particolare con le letture del termometro. Ecco la formula chiave che stabilisce questa relazione:
1/2 mv 2 = kT
Dove M E v— rispettivamente, la massa e la velocità media delle molecole di gas, Tè la temperatura del gas (sulla scala assoluta Kelvin), e K - Costante di Boltzmann. Questa equazione colma il divario tra i due mondi, collegando le caratteristiche del livello atomico (a sinistra) con proprietà volumetriche(sul lato destro), che può essere misurato utilizzando strumenti umani, in questo caso termometri. Questa connessione è fornita dalla costante di Boltzmann K, pari a 1,38 x 10 -23 J/K.
Si chiama branca della fisica che studia le connessioni tra i fenomeni del micromondo e del macromondo meccanica statistica. Difficilmente c'è un'equazione o una formula in questa sezione che non includa la costante di Boltzmann. Uno di questi rapporti fu ricavato dallo stesso austriaco, e si chiama semplicemente Equazione di Boltzmann:
S = K tronco d'albero P + B
Dove S- entropia del sistema ( cm. Seconda legge della termodinamica) P- cosiddetto peso statistico(un elemento molto importante dell'approccio statistico), e B- un'altra costante.
Per tutta la sua vita, Ludwig Boltzmann fu letteralmente in anticipo sui tempi, sviluppando le basi della moderna teoria atomica della struttura della materia, entrando in feroci controversie con la stragrande maggioranza conservatrice della comunità scientifica del suo tempo, che considerava gli atomi solo una convenzione , conveniente per i calcoli, ma non per gli oggetti del mondo reale. Quando il suo approccio statistico non incontrò la minima comprensione nemmeno dopo l’avvento della teoria della relatività ristretta, Boltzmann si suicidò in un momento di profonda depressione. L'equazione di Boltzmann è scolpita sulla sua lapide.
Boltzmann, 1844-1906
Fisico austriaco. Nato a Vienna nella famiglia di un funzionario pubblico. Ha studiato all'Università di Vienna nello stesso corso con Josef Stefan ( cm. Legge di Stefan-Boltzmann). Dopo aver difeso la laurea nel 1866, continuò la sua carriera scientifica, ricoprendo in tempi diversi cattedre nei dipartimenti di fisica e matematica delle università di Graz, Vienna, Monaco e Lipsia. Essendo uno dei principali sostenitori della realtà dell'esistenza degli atomi, ha fatto una serie di eccezionali scoperte teoriche che fanno luce su come i fenomeni a livello atomico influenzano le proprietà fisiche e il comportamento della materia.