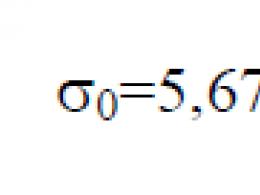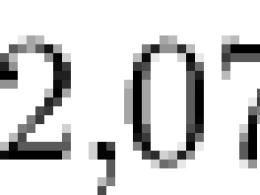Significato fisico della costante di Boltzmann. Ludwig Boltzmann: Risultati personali
I numeri tra parentesi indicano l'errore standard nelle ultime cifre del valore della quantità. In linea di principio, la costante di Boltzmann può essere ottenuta dalla definizione di temperatura assoluta e di altre costanti fisiche (per fare ciò è necessario saper calcolare la temperatura del punto triplo dell'acqua dai principi primi). Ma determinare la costante di Boltzmann utilizzando i principi primi è troppo complesso e irrealistico con l’attuale sviluppo delle conoscenze in questo campo.
La costante di Boltzmann è una costante fisica ridondante se si misura la temperatura in unità di energia, cosa che viene fatta molto spesso in fisica. Si tratta, infatti, di una connessione tra una quantità ben definita - energia e grado, il cui significato si è sviluppato storicamente.
Definizione di entropia
L'entropia di un sistema termodinamico è definita come il logaritmo naturale del numero di diversi microstati Z corrispondenti a un dato stato macroscopico (ad esempio, stati con una data energia totale).
Fattore di proporzionalità K ed è la costante di Boltzmann. Questa espressione, che definisce la relazione tra caratteristiche microscopiche (Z) e macroscopiche (S), esprime l'idea principale (centrale) della meccanica statistica.
Prende il nome dal fisico austriaco Ludwig Boltzmann, che diede importanti contributi alla fisica statistica, nella quale questa costante gioca un ruolo chiave. Il suo valore sperimentale nel sistema SI è
J/.I numeri tra parentesi indicano l'errore standard nelle ultime cifre del valore della quantità. In linea di principio, la costante di Boltzmann può essere ottenuta dalla definizione di temperatura assoluta e di altre costanti fisiche. Tuttavia, allo stato attuale delle conoscenze, calcolare la costante di Boltzmann utilizzando i principi primi è troppo complesso e irrealizzabile. Nel sistema naturale delle unità di Planck, l'unità naturale di temperatura è data in modo che la costante di Boltzmann sia uguale all'unità.
Relazione tra temperatura ed energia
In un gas ideale omogeneo a temperatura assoluta T, l'energia per ciascun grado di libertà traslazionale è uguale, come segue dalla distribuzione di Maxwell KT/2. A temperatura ambiente (300 ) questa energia è ![]() J, o 0,013 eV. In un gas ideale monoatomico ogni atomo ha tre gradi di libertà corrispondenti a tre assi spaziali, il che significa che ogni atomo ha un'energia pari a 3/2( KT)
.
J, o 0,013 eV. In un gas ideale monoatomico ogni atomo ha tre gradi di libertà corrispondenti a tre assi spaziali, il che significa che ogni atomo ha un'energia pari a 3/2( KT)
.
Conoscendo l'energia termica, possiamo calcolare la velocità quadratica media degli atomi, che è inversamente proporzionale alla radice quadrata della massa atomica. La velocità quadratica media a temperatura ambiente varia da 1370 m/s per l'elio a 240 m/s per lo xeno. Nel caso di un gas molecolare la situazione si complica, ad esempio un gas biatomico ha già circa cinque gradi di libertà.
Definizione di entropia
L'entropia di un sistema termodinamico è definita come il logaritmo naturale del numero di diversi microstati Z, corrispondente ad un dato stato macroscopico (ad esempio, uno stato con una data energia totale).
S = K ln Z.Fattore di proporzionalità K ed è la costante di Boltzmann. Questa è un'espressione che definisce la relazione tra microscopico ( Z) e stati macroscopici ( S), esprime l'idea centrale della meccanica statistica.
Guarda anche
Fondazione Wikimedia. 2010.
Scopri cos'è la "costante di Boltzmann" in altri dizionari:
Costante fisica k, pari al rapporto tra la costante universale dei gas R e il numero di Avogadro NA: k = R/NA = 1.3807.10 23 J/K. Prende il nome da L. Boltzmann... Grande dizionario enciclopedico
Una delle costanti fisiche fondamentali; uguale al rapporto tra la costante dei gas R e la costante di Avogadro NA, indicata con k; prende il nome dall'austriaco fisico L. Boltzmann. Il bp è compreso in alcune delle relazioni più importanti della fisica: nell'equazione... ... Enciclopedia fisica
COSTANTE DI BOLZMANN- (k) fisico universale. costante pari al rapporto tra il gas universale (vedi) e la costante di Avogadro NA: k = R/Na = (1.380658 ± 000012)∙10 23 J/K ... Grande Enciclopedia del Politecnico
Costante fisica k, pari al rapporto tra la costante universale dei gas R e il numero di Avogadro NA: k = R/NA = 1.3807·10 23 J/K. Prende il nome da L. Boltzmann. * * * COSTANTE DI BOLTZMANN COSTANTE DI BOLTZMANN, costante fisica k, pari a... ... Dizionario enciclopedico
Fis. costante k, uguale al rapporto dell'universale. costante dei gas R al numero di Avogadro NA: k = R/NA = 1.3807 x 10 23 J/K. Prende il nome da L. Boltzmann... Scienze naturali. Dizionario enciclopedico
Una delle costanti fisiche di base (Vedi Costanti fisiche), pari al rapporto tra la costante universale dei gas R e il numero di Avogadro NA. (numero di molecole in 1 mole o 1 kmol di una sostanza): k = R/NA. Prende il nome da L. Boltzmann. B.p.... ... Grande Enciclopedia Sovietica
Nato nel 1844 a Vienna. Boltzmann è un pioniere e pioniere della scienza. Le sue opere e le sue ricerche erano spesso incomprensibili e rifiutate dalla società. Tuttavia, con l'ulteriore sviluppo della fisica, i suoi lavori furono riconosciuti e successivamente pubblicati.
Gli interessi scientifici dello scienziato coprivano aree fondamentali come la fisica e la matematica. Dal 1867 lavorò come insegnante in numerosi istituti di istruzione superiore. Nella sua ricerca, ha stabilito che ciò è dovuto agli impatti caotici delle molecole sulle pareti del recipiente in cui si trovano, mentre la temperatura dipende direttamente dalla velocità di movimento delle particelle (molecole), in altre parole, dalla loro Pertanto, maggiore è la velocità di movimento di queste particelle, maggiore è la temperatura. La costante di Boltzmann prende il nome dal famoso scienziato austriaco. Fu lui a dare un contributo inestimabile allo sviluppo della fisica statica.
Significato fisico di questa grandezza costante
La costante di Boltzmann definisce la relazione tra temperatura ed energia. Nella meccanica statica svolge un ruolo chiave. La costante di Boltzmann è pari a k=1,3806505(24)*10 -23 J/K. I numeri tra parentesi indicano l'errore consentito del valore rispetto alle ultime cifre. Vale la pena notare che la costante di Boltzmann può essere derivata anche da altre costanti fisiche. Tuttavia, questi calcoli sono piuttosto complessi e difficili da eseguire. Richiedono una conoscenza approfondita non solo nel campo della fisica, ma anche
Costante di Boltzmann (k (\displaystyle k) O kB (\displaystyle k_(\rm (B)))) - una costante fisica che determina la relazione tra temperatura ed energia. Prende il nome dal fisico austriaco Ludwig Boltzmann, che diede importanti contributi alla fisica statistica, nella quale questa costante gioca un ruolo chiave. Il suo valore sperimentale nel Sistema Internazionale di Unità (SI) è:
k = 1.380 648 52 (79) × 10 − 23 (\displaystyle k=1(,)380\,648\,52(79)\times 10^(-23)) J/.I numeri tra parentesi indicano l'errore standard nelle ultime cifre del valore della quantità.
YouTube enciclopedico
1 / 3
✪ Radiazione termica. Legge di Stefan-Boltzmann
✪ Modello distributivo di Boltzmann.
✪ Fisica. MKT: Equazione di Mendeleev-Clapeyron per un gas ideale. Centro di apprendimento in linea di Foxford
Sottotitoli
Relazione tra temperatura ed energia
In un gas ideale omogeneo a temperatura assoluta T (\displaystyle T), l'energia per ogni grado di libertà traslazionale è uguale, come segue dalla distribuzione di Maxwell, k T / 2 (\displaystyle kT/2). A temperatura ambiente (300 ) questa energia è 2 , 07 × 10 − 21 (\displaystyle 2(,)07\times 10^(-21)) J, o 0,013 eV. In un gas ideale monoatomico, ogni atomo ha tre gradi di libertà corrispondenti a tre assi spaziali, il che significa che ogni atomo ha un'energia di 3 2 k T (\displaystyle (\frac (3)(2))kT).
Conoscendo l'energia termica, possiamo calcolare la velocità quadratica media degli atomi, che è inversamente proporzionale alla radice quadrata della massa atomica. La velocità quadratica media a temperatura ambiente varia da 1370 m/s per l'elio a 240 m/s per lo xeno. Nel caso di un gas molecolare la situazione diventa più complicata, ad esempio un gas biatomico ha cinque gradi di libertà (a basse temperature, quando le vibrazioni degli atomi nella molecola non sono eccitate).
Definizione di entropia
L'entropia di un sistema termodinamico è definita come il logaritmo naturale del numero di diversi microstati Z (\displaystyle Z), corrispondente ad un dato stato macroscopico (ad esempio, uno stato con una data energia totale).
S = k ln Z . (\displaystyle S=k\ln Z.)Fattore di proporzionalità k (\displaystyle k) ed è la costante di Boltzmann. Questa è un'espressione che definisce la relazione tra microscopico ( Z (\displaystyle Z)) e stati macroscopici ( S (\displaystyle S)), esprime l'idea centrale della meccanica statistica.
Fissazione del valore presunto
La XXIV Conferenza Generale dei Pesi e delle Misure, tenutasi dal 17 al 21 ottobre 2011, ha adottato una risoluzione in cui, in particolare, si proponeva che la futura revisione del Sistema Internazionale di Unità fosse effettuata in modo tale da fissare il valore della costante di Boltzmann, dopodiché sarà considerata definita esattamente. Di conseguenza, verrà eseguito esatto uguaglianza K=1.380 6X⋅10 −23 J/K, dove X sta per una o più cifre significative, che verranno determinate ulteriormente in base alle raccomandazioni CODATA più accurate. Questa presunta fissazione è associata al desiderio di ridefinire l'unità di temperatura termodinamica kelvin, collegando il suo valore con il valore della costante di Boltzmann.
Costante di Boltzmann (k (\displaystyle k) O kB (\displaystyle k_(\rm (B)))) - una costante fisica che definisce la relazione tra temperatura ed energia. Prende il nome dal fisico austriaco Ludwig Boltzmann, che diede importanti contributi alla fisica statistica, nella quale questa costante gioca un ruolo chiave. Il suo valore nel Sistema Internazionale delle Unità SI secondo i cambiamenti nelle definizioni delle unità SI di base (2018) è esattamente uguale a
k = 1.380 649 × 10 − 23 (\displaystyle k=1(,)380\,649\times 10^(-23)) J/.Relazione tra temperatura ed energia
In un gas ideale omogeneo a temperatura assoluta T (\displaystyle T), l'energia per ogni grado di libertà traslazionale è uguale, come segue dalla distribuzione di Maxwell, k T / 2 (\displaystyle kT/2). A temperatura ambiente (300 ) questa energia è 2 , 07 × 10 − 21 (\displaystyle 2(,)07\times 10^(-21)) J, o 0,013 eV. In un gas ideale monoatomico, ogni atomo ha tre gradi di libertà corrispondenti a tre assi spaziali, il che significa che ogni atomo ha un'energia di 3 2 k T (\displaystyle (\frac (3)(2))kT).
Conoscendo l'energia termica, possiamo calcolare la velocità quadratica media degli atomi, che è inversamente proporzionale alla radice quadrata della massa atomica. La velocità quadratica media a temperatura ambiente varia da 1370 m/s per l'elio a 240 m/s per lo xeno. Nel caso di un gas molecolare, la situazione diventa più complicata, ad esempio, un gas biatomico ha 5 gradi di libertà: 3 traslazionali e 2 rotazionali (a basse temperature, quando le vibrazioni degli atomi nella molecola non sono eccitate e ulteriori gradi di libertà libertà non vengono aggiunte).
Definizione di entropia
L'entropia di un sistema termodinamico è definita come il logaritmo naturale del numero di diversi microstati Z (\displaystyle Z), corrispondente ad un dato stato macroscopico (ad esempio, uno stato con una data energia totale).
S = k ln Z . (\displaystyle S=k\ln Z.)Fattore di proporzionalità k (\displaystyle k) ed è la costante di Boltzmann. Questa è un'espressione che definisce la relazione tra microscopico ( Z (\displaystyle Z)) e stati macroscopici ( S (\displaystyle S)), esprime l'idea centrale della meccanica statistica.