Natrijumova so aminokiselina. Hemijska svojstva
Aminokiseline su organska amfoterna jedinjenja. Oni sadrže dvije funkcionalne grupe suprotne prirode u molekulu: amino grupu sa bazičnim svojstvima i karboksilnu grupu sa kiselim svojstvima. Aminokiseline reaguju i sa kiselinama i sa bazama:
H 2 N -CH 2 -COOH + HCl → Cl [H 3 N-CH 2 -COOH],
H 2 N -CH 2 -COOH + NaOH → H 2 N-CH 2 -COONa + H 2 O.
Kada se aminokiseline rastvore u vodi, karboksilna grupa uklanja ion vodonika, koji se može vezati za amino grupu. U tom slučaju nastaje unutrašnja sol čija je molekula bipolarni ion:
H 2 N-CH 2 -COOH + H 3 N -CH 2 -COO - .
Acid-bazne transformacije aminokiselina u različitim sredinama mogu se predstaviti sljedećim općim dijagramom:

Vodene otopine aminokiselina imaju neutralnu, alkalnu ili kiselu sredinu u zavisnosti od broja funkcionalnih grupa. Tako glutaminska kiselina formira kiseli rastvor (dve -COOH grupe, jedna -NH 2), lizin formira alkalni rastvor (jedna -COOH grupa, dve -NH 2).
Poput primarnih amina, aminokiseline reagiraju s dušičnom kiselinom, pri čemu se amino grupa pretvara u hidrokso grupu, a amino kiselina u hidroksi kiselinu:
H 2 N-CH(R)-COOH + HNO 2 → HO-CH(R)-COOH + N 2 + H 2 O
Mjerenje zapremine oslobođenog dušika nam omogućava da odredimo količinu aminokiseline ( Van Slyke metoda).
Aminokiseline mogu reagirati s alkoholima u prisustvu plinovitog klorovodika, pretvarajući se u estar (tačnije, klorovodičnu sol estera):
H 2 N-CH(R)-COOH + R’OH H 2 N-CH(R)-COOR’ + H 2 O.
Estri aminokiselina nemaju bipolarnu strukturu i hlapljiva su jedinjenja.
Najvažnije svojstvo aminokiselina je njihova sposobnost kondenzacije u peptide.
Kvalitativne reakcije.
1) Sve aminokiseline se oksidiraju ninhidrinom

sa formiranjem proizvoda obojenih plavo-ljubičastom bojom. Iminokiselina prolin daje žutu boju sa ninhidrinom. Ova reakcija se može koristiti za kvantificiranje aminokiselina spektrofotometrijom.
2) Kada se aromatične aminokiseline zagreju sa koncentrovanom azotnom kiselinom, dolazi do nitracije benzenskog prstena i formiraju se žuto obojena jedinjenja. Ova reakcija se zove ksantoprotein(od grčkog xanthos - žuto).
Proteini su polipeptidi prilično velike molekularne težine koji imaju određenu prostornu strukturu, koja ovisi o slijedu aminokiselina uključenih u proteinski lanac. Ova struktura može biti kompaktna (globularni proteini) ili izdužena (fibrilarni proteini). Svi enzimi su globularni proteini, fibrilarni proteini uključuju kolagen, keratin - proteini kože i kose, vrlo jaki i vrlo rastegljivi.
Na osnovu svog sastava, proteini se dijele na jednostavne, koje se sastoje samo od aminokiselina, i složene - komplekse ili kovalentna jedinjenja polipeptida s molekulima drugih klasa:
nukleinske kiseline – nukleoproteini;
polisaharidi – glikoproteini;
lipidi – lipoproteini;
pigmenti – hromoproteini;
ostaci fosforne kiseline - fosfoproteini.
Proteinski dio kompleksnog proteina naziva se apobelcom, neproteinski – protetska grupa. Gotovo svi jednostavni i složeni globularni proteini su enzimi - biološki katalizatori biohemijskih reakcija u živim organizmima.
Zadaci
Zadatak 1. Koja zapremina gasa (u normalnim uslovima) će se osloboditi kada 0,001 mol aminokiseline reaguje sa azotnom kiselinom: a) leucin; b) lizin; c) prolin?
Rješenje
Zapišimo jednadžbe za reakcije navedenih aminokiselina sa dušičnom kiselinom. U slučaju leucina i lizina, deaminacija se događa prema Van Slykeu, a za lizin - na dvije amino grupe sadržane u molekuli. Prolin nema primarnu amino grupu, tako da se proces zaustavlja u fazi N-nitrozacije.
U reakciji (a), broj molova leucina n(Leu) jednak je broju molova oslobođenog dušika n(N2), pa se oslobađa 0,001 mol, odnosno 22,4 ml dušika. U reakciji (b) formira se dvostruka količina gasa 2n(N2) u poređenju sa n(lys), pošto originalna amino kiselina ima dve primarne amino grupe; zapremina oslobođenog azota biće 44,8 ml. U reakciji (c), dušik se ne oslobađa: prolin je jedina od 20 esencijalnih aminokiselina koja ima sekundarni atom dušika u a-poziciji. Kada se nitrozira, formira se N-nitrozo (a ne diazo) jedinjenje.
odgovor: a) 22,4 ml N 2; b) 44,8 ml N 2; c) nema oslobađanja N 2.
Zadatak 2. Kao rezultat tretiranja rastvora koji sadrži 9,36 mg nepoznate aminokiseline sa viškom azotne kiseline na 748 mm Hg. i 20 °C, dobijeno je 2,01 ml azota. Kolika je minimalna molarna masa ove aminokiseline?
Rješenje
Reakcija aminokiseline sa azotnom kiselinom:

Koristeći kombinovani gasni zakon PV/T = konst, izračunajmo zapreminu azota u normalnim uslovima (na temperaturi od 0°C, odnosno 273°K, i pritisku od 760 mm Hg): V 0 (N 2) (n.s.) = (P 1 · V 1 · T 0)/(P 0 ·T 1) = (748·2,01·273)/(760·293) = 1,84 ml.
Pošto je broj molova aminokiselinske supstance i razvijenog gasa N2 isti, napravićemo proporciju:
9,36 mg aminokiseline daje 1,84 ml N 2;
M (molekularna težina aminokiseline) će dati = 22,4 N 2.
M = (9,36·22,4)/1,84 = 114.
Može biti valin: 
Zadatak 3.Životinjski hemoglobin sadrži 0,335% gvožđa (po težini). Kolika je minimalna molarna masa ovog proteina? Koliko je atoma željeza uključeno u molekulu ako je molekulska težina proteina, određena mjerenjem osmotskog tlaka, 67 000?
Rješenje
Maseni udio željeza u hemoglobinu: C%(Fe) = /M(protein), gdje je n broj atoma Fe u molekulu proteina. Neka je n = 1, onda je M(protein)1 = M(Fe) 100%/C%(Fe) = 56 100/0,335 = 16700. Pošto je prava vrijednost (prema uvjetu) izvora M(proteina). = 67000, n = M izvor/M 1 = 67000/16700 = 4.
Zadatak 4. Tokom alkalne hidrolize 48 g dipeptida koji se sastoji od ostataka iste amino kiseline, nastala je samo jedna supstanca - natrijumova so amino kiseline. Masa ove soli je 66,6 g. Utvrdite strukturu dipeptida.
Rješenje
Jednačina reakcije za alkalnu hidrolizu dipeptida:
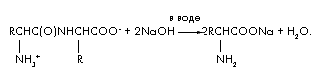
Označimo količinu dipeptida u molovima (dipeptid) = x. Tada se u reakciji hidrolize troši duplo veća količina alkalija (NaOH) = 2x i proizvodi (aminokiseline) = 2x i (H2O) = x. Kreirajmo jednačinu materijalnog bilansa koristeći formulu m = ·M;
m(dipeptid) + m(NaOH) = m(soli aminokiselina) + m(H2O); 48 + 2x 40 = 66,6 + x 18; 62x = 18,6; x = 0,3 mol. M(dipeptid) = m/ = 48/0,3 = 160. M(amino kiseline) = [M(dipeptid) + M(H 2 O)]/2 = 178/2 = 89 g/mol. Aminokiselina je alanin. Dipeptidna struktura: ![]() .
.
I. Po broju funkcionalnih grupa
Monoaminomonokarboksilne kiseline
najjednostavniji predstavnik:

Monoaminodikarboksilne kiseline

Na primjer:

Diaminomonokarboksilne kiseline

Na primjer:

II. Prema relativnom položaju karboksilne i amino grupe
-α-aminokiseline

- β-aminokiseline

- γ-aminokiseline

Formule i nazivi nekih α-aminokiselina, čiji su ostaci dio proteina

Proteini su prirodni polimeri, čije su makromolekule izgrađene od velikog broja ostataka 20 različitih α-amino kiselina. U biohemiji se za aminokiseline obično koriste kratki, trivijalni nazivi i oznake od tri slova.
Monoaminomonokarboksilne kiseline
|
Aminoetanska ili aminooctena kiselina ili glicin (glikokol) |
|
|
2-aminopropanska ili α-aminopropionska kiselina ili alanin |
|
|
2-amino-3-hidroksipropanska, ili α-amino-β-hidroksipropionska kiselina, ili serin |
|
|
2-amino-3-merkaptopropanska kiselina, ili β-merkaptoalanin, ili cistein |
|
|
2-amino-3-fenilpropanska kiselina, ili β-fenilalanin, ili fenilalanin |
|
|
2-amino-3-(4-hidroksifenil)-propanoična kiselina, ili β-(n-hidroksifenil)-apanin, ili tirozin |
|
|
2-amino-3-metilbutanska kiselina, ili α-aminoizovalerična kiselina, ili valin |
Monoaminodikarboksilne kiseline
Diaminomonokarboksilna kiselina
Klasifikacija prirodnih aminokiselina
I. Zamjenjive aminokiseline - mogu se sintetizirati u ljudskom tijelu. Među njima su: glicin, alanin, serin, cistein, tirozin, asparaginska i glutaminska kiselina.
II. Esencijalne aminokiseline se ne mogu sintetizirati u ljudskom tijelu i moraju se u organizam unijeti kao dio proteina hrane. Fenilalanin, valin, lizin su predstavnici esencijalnih aminokiselina.
Fizička svojstva
Većina aminokiselina su bezbojne kristalne supstance koje su visoko rastvorljive u vodi. Mnoge aminokiseline imaju sladak ukus. Tačke topljenja različitih aminokiselina kreću se od 230-300°C.
Hemijska svojstva
Aminokiseline su amfoterna jedinjenja, što je posledica prisustva u njihovim molekulima funkcionalnih grupa kisele (-COOH) i bazične (-NH 2) prirode.
1. Interakcija sa bazama

2. Interakcija sa kiselinama

3. Formiranje unutrašnjih soli (bipolarni joni)
U vodenim rastvorima aminokiseline postoje u obliku ravnotežnih mješavina molekula i bipolarnih iona, koji se u kiseloj sredini pretvaraju u katjonski, a u alkalnoj u anjonski oblik.
a) Monoaminomonokarboksilne kiseline

Kada se formiraju unutrašnje soli monoaminomonokarboksilnih kiselina, priroda medija se ne mijenja. Stoga se ove aminokiseline nazivaju neutralnim. Ukupni naboj unutrašnjih soli takvih kiselina je nula.
Kada se doda kiselina (H+), karboksilatni ion se protonira ostavljajući samo pozitivan naboj na -NH grupi
b) Monoaminodikarboksilne kiseline

Kada se formiraju unutrašnje soli monoaminodikarboksilnih kiselina, nastaje višak vodikovih jona, pa vodene otopine ovih kiselina imaju pH
c) Diaminomonokarboksilne kiseline

Kada se formiraju unutrašnje soli diaminomonokarboksilnih kiselina, nastaje višak hidroksidnih jona, pa njihove vodene otopine imaju pH > 7. Takve aminokiseline nazivamo baznim. Ukupni naboj unutrašnjih soli bazičnih aminokiselina je pozitivan.
4. Formiranje peptida
Kada karboksilna grupa jedne molekule aminokiseline stupi u interakciju sa amino grupom druge molekule aminokiseline, nastaju dipeptidi:

Kada dvije različite aminokiseline interaguju, nastaje mješavina četiri dipeptida; Na primjer:

Dipeptid može dodati još jednu molekulu aminokiseline kako bi formirao tripeptid. Slično, tetrapeptid se može dobiti iz tripeptida, itd.
5. Formiranje derivata na karboksilnoj grupi
Kao i karboksilne kiseline, aminokiseline mogu formirati estre, kiselinske kloride, itd. Na primjer:

6. Polikondenzacija ε-aminokaproične kiseline

Metode dobijanja
1. Amonoliza α-halokarboksilnih kiselina
2. Hidroliza proteina
Aminokiseline sadrže amino i karboksilne grupe i ispoljavaju sva svojstva karakteristična za spojeve sa takvim funkcionalnim grupama. Prilikom pisanja aminokiselinskih reakcija koriste se formule s nejoniziranim amino i karboksi skupinama.
1) reakcije na amino grupi. Amino grupa u aminokiselinama pokazuje uobičajena svojstva amina: amini su baze i djeluju kao nukleofili u reakcijama.
1. Reakcija aminokiselina kao baza. Kada aminokiseline interaguju sa kiselinama, nastaju amonijeve soli:
glicin hidrohlorid, so glicin hidrohlorida
2. Djelovanje dušične kiseline. Kada djeluje dušična kiselina, nastaju hidroksi kiseline i oslobađaju se dušik i voda:
Ova reakcija se koristi za kvantitativno određivanje slobodnih aminskih grupa u aminokiselinama, kao iu proteinima.
3. Formiranje N - acil derivata, reakcija acilacije.
Aminokiseline reagiraju s anhidridima i kiselinskim halogenidima, formirajući N-acil derivate aminokiselina:
Benzil ester natrijeva sol N karbobenzoksiglicin - kloroformični glicin
Acilacija je jedan od načina zaštite amino grupe. N-acil derivati su od velike važnosti u sintezi peptida, jer se N-acilni derivati lako hidroliziraju i formiraju slobodnu amino grupu.
4. Formiranje Schiffovih baza. Kada a-amino kiseline stupaju u interakciju s aldehidima, supstituirani imini (Schiffove baze) nastaju kroz fazu formiranja karbinolamina:
alanin formaldehid N-metilol derivat alanina
5. Reakcija alkilacije. Amino grupa u a-amino kiselini je alkilirana kako bi se formirali N-alkil derivati:
Reakcija sa 2,4-dinitrofluorobenzenom je od najveće važnosti. Dobijeni derivati dinitrofenila (derivati DNP) koriste se za uspostavljanje aminokiselinske sekvence peptida i proteina. Interakcija a-amino kiselina sa 2,4-dinitrofluorobenzenom je primjer reakcije nukleofilne supstitucije u benzenskom prstenu. Zbog prisustva dvije jake grupe koje povlače elektrone u benzenskom prstenu, halogen postaje pokretljiv i prolazi kroz reakciju supstitucije:
 |
2.4 – dinitro -
fluorobenzen N - 2,4 - dinitrofenil - a - aminokiselina
(DNPB) DNP - derivati a - aminokiselina
6.Reakcija sa fenil izotiocijanatom. Ova reakcija se široko koristi u određivanju strukture peptida. Fenil izotiocijanat je derivat izotiocijanske kiseline H-N=C=S. Interakcija a-amino kiselina sa fenil izotiocijanatom odvija se kroz mehanizam nukleofilne reakcije adicije. Rezultirajući proizvod zatim prolazi kroz reakciju intramolekularne supstitucije, što dovodi do stvaranja cikličkog supstituiranog amida: feniltiohidantoina.
Ciklična jedinjenja se dobijaju u kvantitativnom prinosu i predstavljaju fenil derivate tiohidantoina (PTH – derivati) – aminokiselina. PTG derivati se razlikuju po strukturi R radikala.
Osim običnih soli, a-amino kiseline mogu, pod određenim uvjetima, formirati intrakompleksne soli s katjonima teških metala. Sve a-aminokiseline odlikuju se prekrasno kristalizirajućim, intenzivno plavo obojenim intrakompleksnim (kelatnim) solima bakra:
Alanin etil ester
Formiranje estera je jedna od metoda za zaštitu karboksilne grupe u sintezi peptida.
3. Formiranje kiselih halogenida. Pri djelovanju na a-aminokiseline sa zaštićenom amino grupom sa sumpor oksidikloridom (tionil hlorid) ili fosfor oksid trihloridom (fosfor oksihlorid) nastaju kiseli hloridi:
Proizvodnja kiselih halogenida jedan je od načina za aktiviranje karboksilne grupe u sintezi peptida.
4.Dobijanje anhidrida a-aminokiselina. Kiseli halogenidi su vrlo reaktivni, što smanjuje selektivnost reakcije kada se koristi. Stoga je češće korištena metoda za aktiviranje karboksilne grupe u sintezi peptida da se ona pretvori u anhidridnu grupu. Anhidridi su manje aktivni od kiselinskih halogenida. Kada a-amino kiselina koja ima zaštićenu amino grupu stupi u interakciju s etil hloromravljom kiselinom (etil kloroformijatom), formira se anhidridna veza:
5. Dekarboksilacija. a - Aminokiseline koje imaju dvije grupe koje povlače elektrone na istom atomu ugljika lako se dekarboksiliraju. U laboratorijskim uvjetima to se provodi zagrijavanjem aminokiselina sa barijevim hidroksidom. Ova reakcija se odvija u tijelu uz sudjelovanje enzima dekarboksilaze uz stvaranje biogenih amina:
ninhidrin
Odnos aminokiselina prema toplini. Kada se a-aminokiseline zagrijavaju, nastaju ciklički amidi koji se nazivaju diketopiperazini:

Diketopiperazin
g - i d - aminokiseline lako odvajaju vodu i cikliziraju da formiraju unutrašnje amide, laktame:
g - laktam (butirolaktam)
U slučajevima kada su amino i karboksilne grupe razdvojene sa pet ili više atoma ugljika, pri zagrijavanju dolazi do polikondenzacije s formiranjem polimernih poliamidnih lanaca uz eliminaciju molekula vode.
Koji obavlja važne biološke funkcije u živim organizmima, učestvuje u biosintezi proteina, odgovoran je za normalnu aktivnost nervnog sistema i reguliše metaboličke procese. Aminooctena kiselina, umjetno dobivena, koristi se u farmaciji, medicini i prehrambenoj industriji.
Aditiv za hranu E640 kombinuje pod jednim brojem za označavanje aminooctenu kiselinu (glicin) i njenu natrijumovu so - jedinjenja koja se koriste za optimizaciju ukusa i arome proizvoda. Dodatak je siguran i službeno odobren u većini zemalja svijeta.
Glicin i njegova natrijumova so: opšte informacije
Glicin, poznat i kao aminooctena ili aminoetanska kiselina, pripada nizu neesencijalnih aminokiselina – najjednostavnijih organskih struktura koje su dio proteina i njihovih spojeva. Supstanca, dobijena umjetno, je bezbojni prah bez mirisa i slatkastog okusa.
U industrijskim razmjerima, glicin se proizvodi kombinacijom hloroctene kiseline i amonijaka. Aminooctena kiselina, zauzvrat, ima svojstvo stvaranja kompleksnih soli (glicinata) s ionima metala.
Natrijum glicinat je so natrijuma i aminosirćetne kiseline, koja je takođe supstanca sintetičkog porekla. Uprkos činjenici da su glicin i njegova so različita hemijska jedinjenja, u prehrambenoj industriji obavljaju identične funkcije kao modifikatori ukusa i arome, kombinovani su pod jednim brojem etikete i smatraju se aditivom E640.
| Ime | Glycine |
|---|---|
| Sinonimi | Aminoctena (aminoetanska) kiselina, glikokol (zastareo) |
| Grupa | Neesencijalne aminokiseline |
| Hemijska formula | NH 2 – CH 2 – COOH |
| Struktura | Fini monoklinski kristali (kristalni prah) |
| Boja | bijela (bezbojna) |
| Miris | Odsutan |
| Taste | Slatko |
| Rastvorljivost | Potpuno rastvorljiv u, delimično rastvorljiv u. Ne rastvara se u eteru |
| Dodatni kod | E640 (uključujući natrijumovu so) |
| Porijeklo | Sintetički |
| Toksičnost | Sigurno kada se konzumira u normalnim granicama |
| Područja upotrebe | Prehrambena industrija, farmacija, medicina, kozmetologija |
Biološka uloga glicina i njegovi izvori
Glicin se nalazi u proteinskim molekulima mnogo češće nego druge aminokiseline i obavlja važne biološke funkcije. U ljudskom tijelu ova aminokiselina se sintetizira transaminacijom (reverzibilnim prijenosom amino grupe) glioksilata ili enzimskim cijepanjem holina i serina.
Aminooctena kiselina je prekursor porfirina i purina, čija se biosinteza odvija u živim stanicama, ali biološka uloga ovog spoja nije ograničena na ove funkcije. Glicin je također neurotransmiter koji je uključen u prijenos nervnih impulsa, reguliše proizvodnju drugih aminokiselina i ima "inhibitorni" učinak na neurone i motorne neurone.
Tijelo zdrave osobe samostalno sintetizira aminokiseline u potrebnim količinama, tako da u pravilu nema potrebe za njihovom upotrebom u lijekovima i dodacima prehrani. Izvori hrane aminooctene kiseline uključuju životinjske proizvode (goveđa jetra), orašaste plodove i neko voće.
Učinak glicina i njegove natrijumove soli na ljudski organizam
Aminosirćetna kiselina kao neurotransmiter obavlja regulatorne funkcije i prvenstveno utiče na centralni i periferni nervni sistem. Glicin ima nootropna svojstva, normalizuje metabolizam, aktivira zaštitne funkcije centralnog nervnog sistema i ima blago umirujuće dejstvo.
Pozitivni efekti glicina na ljudski organizam:
- smanjenje emocionalne napetosti, anksioznosti, stresa, agresivnosti;
- poboljšano raspoloženje i normalizacija sna;
- opuštanje mišića i ublažavanje grčeva;
- povećane performanse;
- smanjenje nuspojava uzimanja psihotropnih lijekova;
- smanjenje težine vegetativno-vaskularnih poremećaja;
- smanjenje želje za alkoholom i slatkišima.
Kao dio dodatka E640, glicin i njegova sol nemaju navedena svojstva i nemaju ni pozitivne ni negativne učinke na ljudski organizam kada se konzumiraju u granicama normale. Dodatak hrani ne predstavlja prijetnju zdravlju, ali u slučaju individualne netolerancije može izazvati alergijsku reakciju.
Potencijalne opasnosti mogu biti od nečistoća u aditivu i nekvalitetnih prehrambenih proizvoda u čijoj se proizvodnji koriste optimizatori ukusa i arome.
Primjena glicina i njegove natrijumove soli
Primjena glicina i natrijevog glicinata uglavnom je ograničena na prehrambenu industriju, medicinu i farmaceutske proizvode. Međutim, aminooctena kiselina je našla primjenu i u kozmetičkoj industriji zbog svoje hipoalergenosti i antioksidativnog učinka.
Kozmetika koja sadrži aditiv E640:
- medicinski šamponi za oslabljenu kosu i proizvodi protiv ćelavosti;
- kozmetika protiv starenja, hidratantne kreme i maske za sve tipove kože;
- Serumi i tonici za čišćenje;
- ruževe i balzame.
Zdrobljene tablete glicina mogu se koristiti za izradu domaćih proizvoda za njegu kože i dodati u hidratantne maske i kreme. Aminooctena kiselina potiče prodiranje vrijednih nutritivnih komponenti u duboke slojeve dermisa i pojačava djelovanje ljekovite kozmetike.
Aditiv E640 u prehrambenoj industriji
 Glicin i natrijum glicinat se aktivno koriste u tehnološkim procesima za proizvodnju alkoholnih pića. Dodatak E640 posebno je uključen u elitnu votku, koji pomaže u neutralizaciji neugodnog mirisa i omekšavanju oštrog okusa. Postoji i mišljenje da prisustvo glicina u alkoholnim pićima pomaže u smanjenju toksičnog dejstva alkohola na nervni sistem i sprečava mamurluk.
Glicin i natrijum glicinat se aktivno koriste u tehnološkim procesima za proizvodnju alkoholnih pića. Dodatak E640 posebno je uključen u elitnu votku, koji pomaže u neutralizaciji neugodnog mirisa i omekšavanju oštrog okusa. Postoji i mišljenje da prisustvo glicina u alkoholnim pićima pomaže u smanjenju toksičnog dejstva alkohola na nervni sistem i sprečava mamurluk.
Prehrambeni proizvodi koji sadrže aditiv E640:
- jaka alkoholna pića;
- džemovi, konzerve, želei, ;
- pakirani sokovi s pulpom;
- obogaćeno kuhanje;
- Sportski vitaminski napici;
- umaci, začini i začini.
Aminooctena kiselina se koristi ne samo za optimizaciju okusa i transporta biološki aktivnih tvari, već i kao antibakterijsko sredstvo. Konkretno, koristi se za tretiranje mesa, ribe i morskih plodova za neutralizaciju opasnih E. coli.
Medicinska upotreba
Glicin se aktivno koristi za liječenje i prevenciju bolesti povezanih s centralnim i perifernim nervnim sistemom. Ova supstanca je deo farmaceutskih preparata sa nootropnim, sedativnim, antikonvulzivnim i hipnotičkim dejstvom, a ima blago antidepresivno i umirujuće dejstvo.
Medicinske indikacije za upotrebu aminooctene kiseline kao lijeka:
- smanjene mentalne performanse, poremećaji spavanja i pamćenja;
- emocionalna napetost, stresne situacije, neuroze;
- emocionalna nestabilnost i povećana razdražljivost;
- posljedice ishemijskog moždanog udara, traumatske ozljede mozga i neuroinfekcija;
- vegetativno-vaskularna distonija, ishemija;
- povećan mišićni tonus, grčevi u mišićima;
- ovisnost o alkoholu i drogama, toksično djelovanje lijekova koji depresiraju centralni nervni sistem.
Dokazano je da konzumacija 3 g glicina dnevno pozitivno utiče na mentalne sposobnosti i opšte emocionalno stanje osobe, ublažava pospanost tokom dana i normalizuje noćni san. Lijek se propisuje i trudnicama za smanjenje anksioznosti, djeci i adolescentima koji imaju poteškoća sa socijalnom adaptacijom i koncentracijom.
Aditiv E640 i zakonodavstvo
Optimizator ukusa i mirisa E640 se koristi u proizvodnji hrane u većini zemalja svijeta, ali u Codex Alimentariusu nema podataka o aditivu. Nije bilo slučajeva trovanja glicinom i natrijum glicinatom kada se konzumira kao hrana, pa se modifikator E640 smatra sigurnim.
Aditiv je uvršten na listu zvanično odobrenih proizvoda za upotrebu u prehrambenoj industriji u Evropskoj uniji, SAD i Kanadi. Zakonodavstvo Ruske Federacije i Bjelorusije također dozvoljava prisustvo E640 u proizvodima unutar dozvoljenih granica koje je utvrdio SanPiN. Nema podataka o upotrebi E640 kao pojačivača okusa i arome u Ukrajini.
Unatoč činjenici da glicin i njegova sol nemaju toksični učinak na ljudsko tijelo i odobreni su za upotrebu, proizvodi koji sadrže E640 teško se mogu nazvati korisnim. Većina aroma i aroma se koristi kako bi privukli pažnju kupca na proizvode niske kvalitete, čiju upotrebu treba svesti na minimum.