Постоянная больцмана в уравнении. Универсальная газовая постоянная — универсальная, фундаментальная физическая константа R, равная произведению постоянной Больцмана k на постоянную Авогадро
Согласно закону Стефана – Больцмана плотность интегрального полусферического излучения E 0 зависит только от температуры и изменяется пропорционально четвертой степени абсолютной температуры T :
Стефана – Больцмана постоянная σ 0 – физическая постоянная, входящая в закон, определяющий объемную плотность равновесного теплового излучения абсолютно черного тела:

Исторически закон Стефана-Больцмана был сформулирован раньше закона излучения Планка, из которого он вытекает как следствие. Закон Планка устанавливает зависимость спектральной плотности потока излучения E 0 от длины волны λ и температуры T :

где λ – длина волны, м; с
=2,998 10 8 м/с – скорость
света в вакууме; Т
– температура тела, К;
h
= 6,625 ×10 -34 Дж×с– постоянная Планка.
Физическая постоянная k , равная отношению универсальной газовой постоянной R =8314Дж/(кг× K) к числу Авогадро NA =6,022× 10 26 1/(кг× моль):
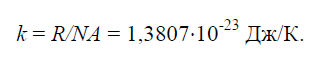
Число различных конфигураций системы из N частиц для данного набора чисел n i (число частиц, находящихся в i -том состоянии, которому соответствует энергия e i ) пропорционально величине:

Величина W есть число способов распределения N частиц по энергетическим уровням. Если справедливо соотношение (6) то считается, что исходная система подчиняется статистике Больцмана. Набор чисел n i , при котором число W максимально, встречается наиболее часто и соответствует наиболее вероятному распределению.
Физическая кинетика – микроскопическая теория процессов в статистически неравновесных системах.
Описание большого числа частиц может успешно осуществляться вероятностными методами. Для одноатомного газа состояние совокупности молекул определяется их координатами и значениями проекций скоростей на соответствующие координатные оси. Математически это описывается функцией распределения, характеризующей вероятность пребывания частицы в данном состоянии:

есть ожидаемое число молекул в объеме d d , координаты которых находятся в интервале от до +d , а скорости в интервале от до +d.
Если осредненной по времени потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией, то газ называется идеальным. Идеальный газ называется газом Больцмана, если отношение длины пробега молекул в этом газе к характерному размеру течения L конечно, т.е.

т.к. длина пробега обратно пропорциональна nd 2 (n – числовая плотность 1/м 3 , d – диаметр молекулы, м).
Величину
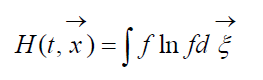
называют H -функцией Больцмана для единицы объема, которая связана с вероятностью обнаружения системы из молекул газа в данном состоянии. Каждому состоянию соответствуют определенные числа заполнения шестимерных пространственно-скоростных ячеек, на которые может быть разбито фазовое пространство рассматриваемых молекул. Обозначим W вероятность того, что в первой ячейке рассматриваемого пространства окажется N 1 молекул, во второй N 2 и т.д.
С точностью до постоянной, определяющей начало отсчета вероятности, правомерно соотношение:
 ,
,
где 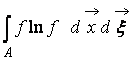 – H-функция области
пространства А
, занятой газом. Из (9) видно, что W
и H
взаимосвязаны, т.е. изменение вероятности состояния приводит к соответствующей
эволюции H функции.
– H-функция области
пространства А
, занятой газом. Из (9) видно, что W
и H
взаимосвязаны, т.е. изменение вероятности состояния приводит к соответствующей
эволюции H функции.

Больцмана принцип устанавливает связь между энтропией S физической системы и термодинамической вероятностью W её состояния:

(печатается по изданию: Коган М.Н. Динамика разреженного газа. – М.: Наука, 1967.)
Общий вид КУБ:

где – массовая сила, обусловленная наличием различных полей (гравитационного, электрического, магнитного), действующая на молекулу; J – интеграл столкновений. Именно этот член уравнения Больцмана учитывает столкновения молекул друг с другом и соответствующие изменения скоростей взаимодействующих частиц. Интеграл столкновений представляет собой пятимерный интеграл и имеет следующую структуру:

Уравнение (12) с интегралом (13) получено для столкновения молекул, при которых не возникает тангенциальных сил, т.е. сталкивающиеся частицы считаются идеально гладкими.
В процессе
взаимодействия внутренняя энергия молекул не меняется, т.е. предполагается, что
эти молекулы являются идеально упругими. Рассматриваются две группы молекул,
имеющих до соударения друг с другом (столкновения) скорости и (рис. 1), а после
столкновения соответственно скорости и . Разность скоростей и называется
относительной скоростью, т.е. . Ясно, что для гладкого упругого
столкновения .
Функции распределения f 1 ", f", f 1 ,f
описывают
молекулы соответствующих групп после и до столкновений, т.е. ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.

Рис. 1. Столкновение двух молекул.
В (13) входят два параметра, характеризующие расположение сталкивающихся молекул друг относительно друга: b и ε; b – прицельное расстояние, т.е. наименьшее расстояние, на которое сблизились бы молекулы при отсутствии взаимодействия (рис. 2); ε называют угловым параметром столкновений (рис. 3). Интегрирование по b от 0 до ¥ и по от 0 до 2p (два внешних интеграла в (12)) охватывает всю плоскость силового взаимодействия перпендикулярно вектору

Рис. 2. Траектория движения молекул.

Рис. 3. Рассмотрение взаимодействия молекул в цилиндрической системе координат: z , b , ε
Кинетическое уравнение Больцмана выведено при следующих допущениях и предположениях.
1. Считается, что происходит в основном столкновения двух молекул, т.е. роль столкновений одновременно трех и большего числа молекул незначительна. Это допущение позволяет использовать для анализа одночастичную функцию распределения, которая выше названа просто функцией распределения. Учет столкновения трех молекул приводит к необходимости использования в исследовании двухчастичной функции распределения. Соответственно анализ существенно усложняется.
2. Предположение о молекулярном хаосе. Оно выражается в том, что вероятности обнаружения частицы 1 в фазовой точке и частицы 2 в фазовой точке независимы друг от друга.
3.
Равновероятны столкновения молекул с любым прицельным расстоянием, т.е. функция
распределения не меняется на диаметре взаимодействия. Необходимо отметить, что
анализируемый элемент должен быть малым, чтобы f
в пределах этого элемента не менялась, но в то же время
чтобы
не была велика относительная флуктуация ~
. Потенциалы
взаимодействия, используемые при вычислении интеграла столкновений, являются
сферически симметричными, т.е. ![]() .
.
Распределение Максвелла-Больцмана
Равновесное состояние газа описывается абсолютным Максвелловским распределением, которое является точным решением кинетического уравнения Больцмана:

где m – масса молекулы, кг.
Общее локально-максвелловское распределение иначе называемое распределение Максвелла-Больцмана:

в том случае, когда газ движется
как целое со скоростью и переменные n
,
T
зависят от координаты
и времени t
.
В поле тяготения Земли точное решение уравнения Больцмана показывает:

где n 0 = плотность у поверхности Земли, 1/м 3 ; g – ускорение силы тяжести, м/с 2 ; h – высота, м. Формула (16) является точным решением кинетического уравнения Больцман либо в безграничном пространстве, либо при наличии границ, не нарушающих этого распределения, при этом температура также должна оставаться постоянной.
Эта страница оформлена Пузиной Ю.Ю. при поддержке Российского Фонда Фундаментальных Исследований – проект №08-08-00638.
Среди фундаментальных постоянных постоянная Больцмана k занимает особое место. Ещё в 1899 г. М. Планк предлагал следующие четыре числовых константы в качестве фундаментальных для построения единой физики: скорость света c , квант действия h , гравитационную постоянную G и постоянную Больцмана k . Среди этих констант k занимает особое место. Она не определяет элементарных физических процессов и не входит в основные принципы динамики, но устанавливает связь между микроскопическими динамическими явлениями и макроскопическими характеристиками состояния частиц. Она же входит в фундаментальный закон природы, связывающий энтропию системы S с термодинамической вероятностью её состояния W :
S=klnW (формула Больцмана)
и определяющий направленность физических процессов в природе. Особое внимание следует обратить на то, что появление постоянной Больцмана в той или иной формуле классической физики всякий раз совершенно отчётливо указывает на статистический характер описываемого ею явления. Понимание физической сущности постоянной Больцмана требует вскрытия громадных пластов физики - статистики и термодинамики, теории эволюции и космогонии.
Исследования Л. Больцмана
Начиная с 1866 г. Одна за другой выходят в свет работы австрийского теоретика Л. Больцмана. В них статистическая теория получает столь солидное обоснование, что превращается в подлинную науку о физических свойствах коллективов частиц.
Распределение было получено Максвеллом для простейшего случая одноатомного идеального газа. В 1868 г. Больцман показывает, что и многоатомные газы в состоянии равновесия будут также описываться распределением Максвелла.
Больцман развивает в трудах Клаузиуса представление о том, что газовые молекулы нельзя рассматривать как отдельные материальные точки. У многоатомных молекул имеются ещё вращение молекулы как целого и колебания составляющих её атомов. Он вводит в рассмотрение число степеней свободы молекул как число «переменных, требующихся для определения положения всех составных частей молекулы в пространстве и их положения друг относительно друга» и показывает, что из данных эксперимента по теплоёмкости газов следует равномерное распределение энергии между различными степенями свободы. На каждую степень свободы приходится одна и та же энергия
Больцмана напрямую связал характеристики микромира с характеристиками макромира. Вот ключевая формула, устанавливающая это соотношение:
1/2 mv2 = kT
где m и v - соответственно масса и средняя скорость движения молекул газа, Т - температура газа (по абсолютной шкале Кельвина), а k - постоянная Больцмана. Это уравнение прокладывает мостик между двумя мирами, связывая характеристики атомного уровня (в левой части) с объемными свойствами (в правой части), которые можно измерить при помощи человеческих приборов, в данном случае термометров. Эту связь обеспечивает постоянная Больцмана k, равная 1,38 x 10-23 Дж/К.
Заканчивая разговор о постоянной Больцмана, хочется ещё раз подчеркнуть её фундаментальное значение в науке. Она содержит в себе громадные пласты физики - атомистика и молекулярно-кинетическая теория строения вещества, статистическая теория и сущность тепловых процессов. Изучение необратимости тепловых процессов раскрыло природу физической эволюции, сконцентрировавшейся в формуле Больцмана S=klnW. Следует подчеркнуть, что положение, согласно которому замкнутая система рано или поздно придёт в состояние термодинамического равновесия, справедливо лишь для изолированных систем и систем, находящихся в стационарных внешних условиях. В нашей Вселенной непрерывно происходят процессы, результатом которых является изменение её пространственных свойств. Нестационарность Вселенной неизбежно приводит к отсутствию в ней статистического равновесия.
(k или k B) – физическая постоянная, определяющая связь между температурой и энергией. Названа в честь австрийского физика Людвига Больцмана, сделавшего большой вклад в статистическую физику, в которой эта стала занимает ключевую позицию. Ее экспериментальное значение в системе СИ равенЧисла в круглых скобках указывают стандартную погрешность в последних цифрах значения величины. В принципе, постоянную Больцмана можно получить из определения абсолютной температуры и других физических констант (для этого нужно уметь рассчитать из первых принципов температуру тройной точки воды). Но определение постоянной Больцмана с помощью основных принципов слишком сложное и нереальное при современном развитии знаний в этой области.
Постоянная Больцмана – излишняя физическая постоянная, если измерять температуру в единицах энергии, что очень часто делается в физике. Она, собственно, связью между хорошо определенной величиной – энергией и градусом, значение которого сложилось исторически.
Определение энтропии
Энтропия термодинамической системы определяется как натуральный логарифм от числа различных микросостояния Z, соответствующих данному макроскопическому состоянию (например, состояния с заданной полной энергией).
Коэффициент пропорциональности k
и является постоянной Больцмана. Это выражение, определяющее связь между микроскопическими (Z) и макроскопическими (S) характеристиками, выражает главную (центральную) идею статистической механики.
Родился в 1844 году в Вене. Больцман является первопроходцем и первооткрывателем в науке. Его работы и исследования часто были непонятны и отвергнуты обществом. Однако с дальнейшим развитием физики его труды были признаны и впоследствии опубликованы.
Научные интересы ученого охватывали такие фундаментальные области, как физика и математика. С 1867 года он работал преподавателем в ряде высших учебных заведений. В своих исследованиях он установил, что обусловлено хаотическими ударами молекул о стенки сосуда, в котором они находятся, в то время как температура напрямую зависит от скорости движения частиц (молекул), иными словами, от их Следовательно, чем с большей скоростью движутся эти частицы, тем выше и температура. Постоянная Больцмана названа в честь знаменитого австрийского ученого. Именно он внес неоценимый вклад в развитие статической физики.
Физический смысл данной постоянной величины
Постоянная Больцмана определяет связь между такими как температура и энергия. В статической механике она играет главную ключевую роль. Постоянная Больцмана равна k=1,3806505(24)*10 -23 Дж/К. Числа, находящиеся в круглых скобках, указывают на допустимую погрешность значения величины относительно последних цифр. Стоит отметить, что постоянная Больцмана также может быть получена из других физических постоянных. Однако эти вычисления достаточно сложны и трудновыполнимы. Они требуют глубоких познаний не только в области физики, но и
Постоянная Больцмана перекидывает мост из макромира в микромир, связывая температуру с кинетической энергией молекул.
Людвиг Больцман — один из создателей молекулярно-кинетической теории газов, на которой зиждется современная картина взаимосвязи между движением атомов и молекул с одной стороны и макроскопическими свойствами материи, такими как температура и давление, с другой. В рамках такой картины давление газа обусловлено упругими ударами молекул газа о стенки сосуда, а температура — скоростью движения молекул (а точнее, их кинетической энергией).Чем быстрее движутся молекулы, тем выше температура.
Постоянная Больцмана дает возможность напрямую связать характеристики микромира с характеристиками макромира — в частности, с показаниями термометра. Вот ключевая формула, устанавливающая это соотношение:
1/2 mv 2 = kT
где m и v — соответственно масса и средняя скорость движения молекул газа, Т — температура газа (по абсолютной шкале Кельвина), а k — постоянная Больцмана. Это уравнение прокладывает мостик между двумя мирами, связывая характеристики атомного уровня (в левой части) с объемными свойствами (в правой части), которые можно измерить при помощи человеческих приборов, в данном случае термометров. Эту связь обеспечивает постоянная Больцмана k , равная 1,38 x 10 -23 Дж/К.
Раздел физики, изучающий связи между явлениями микромира и макромира, называется статистическая механика. В этом разделе едва ли найдется уравнение или формула, в которых не фигурировала бы постоянная Больцмана. Одно из таких соотношений было выведено самим австрийцем, и называется оно просто уравнение Больцмана :
S = k log p + b
где S — энтропия системы (см. Второе начало термодинамики), p — так называемый статистический вес (очень важный элемент статистического подхода), а b — еще одна константа.
Всю жизнь Людвиг Больцман в буквальном смысле опережал свое время, разрабатывая основы современной атомной теории строения материи, вступая в яростные споры с подавляющим консервативным большинством современного ему научного сообщества, считавшего атомы лишь условностью, удобной для расчетов, но не объектами реального мира. Когда его статистический подход не встретил ни малейшего понимания даже после появления специальной теории относительности, Больцман в минуту глубокой депрессии покончил с собой. Уравнение Больцмана высечено на его надгробном памятнике.
Boltzmann, 1844-1906
Австрийский физик. Родился в Вене в семье госслужащего. Учился в Венском университете на одном курсе с Йозефом Стефаном (см. Закон Стефана—Больцмана). Защитившись в 1866 году, продолжил научную карьеру, занимая в разное время профессорские должности на кафедрах физики и математики университетов Граца, Вены, Мюнхена и Лейпцига. Будучи одним из главных сторонников реальности существования атомов, сделал ряд выдающихся теоретических открытий, проливающих свет на то, каким образом явления на атомном уровне сказываются на физических свойствах и поведении материи.