Натриевая соль аминокислоты. Химические свойства
Аминокислоты — это органические амфотерные соединения. Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами. Аминокислоты реагируют как с кислотами, так и с основаниями:
Н 2 N -СН 2 -СООН + HCl → Сl [Н 3 N-СН 2 -СООН],
Н 2 N -СН 2 -СООН + NaOH → H 2 N-CH 2 -COONa + Н 2 О.
При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
H 2 N-CH 2 -СООН + Н 3 N -СН 2 -СОO — .
Кислотно-основные превращения аминокислот в различных средах можно изобразить следующей общей схемой:

Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH 2), лизин — щелочной (одна группа -СООН, две -NH 2).
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота - в гидроксикислоту:
H 2 N-CH(R)-COOH + HNO 2 → HO-CH(R)-COOH + N 2 + H 2 O
Измерение объема выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка ).
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир (точнее, в хлороводородную соль эфира):
H 2 N-CH(R)-COOH + R’OH H 2 N-CH(R)-COOR’ + Н 2 О.
Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
Важнейшее свойство аминокислот - их способность к конденсации с образованием пептидов.
Качественные реакции .
1) Все аминокислоты окисляются нингидрином

с образованием продуктов, окрашенных в сине-фиолетовый цвет. Иминокислота пролин дает с нингидрином желтое окрашивание. Эта реакция может быть использована для количественного определения аминокислот спектрофотометрическим методом.
2) При нагревании ароматических аминокислот с концентрированной азотной кислотой происходит нитрование бензольного кольца и образуются соединения, окрашенные в желтый цвет. Эта реакция называется ксантопротеиновой (от греч. ксантос - желтый).
Белки – это полипептиды достаточно
большой молекулярной массы, имеющие
определенную пространственную структуру,
которая зависит от последовательности входящих
в белковую цепь аминокислот. Эта структура может
быть компактной (глобулярные белки) или
вытянутой (фибриллярные белки). Все ферменты –
глобулярные белки, к фибриллярным же относятся
коллаген, кератин – белки кожи, волос, очень
прочные и хорошо растяжимые.
По составу белки делят на простые, состоящие
только из аминокислот, и сложные – комплексы или
ковалентные соединения полипептидов с
молекулами других классов:
нуклеиновыми кислотами –
нуклеопротеиды;
полисахаридами – гликопротеины;
липидами – липопротеиды;
пигментами – хромопротеиды;
остатками фосфорной кислоты – фосфопротеиды.
Белковую часть сложного белка называют апобелком , небелковую – простетической группой . Почти все простые и сложные глобулярные белки являются ферментами – биологическими катализаторами биохимических реакций в живых организмах.
Задачи
Задача 1. Какой объем газа (в нормальных условиях) выделится при реакции с азотистой кислотой 0,001 моля аминокислоты: а) лейцина; б) лизина; в) пролина?
Решение
Запишем уравнения реакций перечисленных аминокислот с азотистой кислотой. В случае лейцина и лизина происходит дезаминирование по Ван-Слайку, причем у лизина – по двум аминогруппам, содержащимся в молекуле. В пролине нет первичной аминогруппы, поэтому процесс останавливается на стадии N-нитрозирования.
В реакции (а) количество молей лейцина n(Лей) равно количеству молей выделевшегося азота n(N 2), поэтому выделяется 0,001 моля, или 22,4 мл азота. В реакции (б) образуется удвоенное количество газа 2n(N 2) по сравнению с n(лиз), так как в исходной аминокислоте две первичные аминогруппы; объем выделившегося азота составит 44,8 мл. В реакции (в) азот не выделяется: пролин – единственная из 20 важнейших аминокислот, у которой в a-положении находится вторичный атом азота. При его нитрозировании образуется N-нитрозо- (а не диазо-) соединение.
Ответ: а) 22,4 мл N 2 ; б) 44,8 мл N 2 ; в) нет выделения N 2 .
Задача 2. В результате обработки раствора, содержащего 9,36 мг неизвестной аминокислоты, избытком азотистой кислоты при 748 мм рт.ст. и 20 °С получено 2,01 мл азота. Какова минимальная молярная масса этой аминокислоты?
Решение
Реакция аминокислоты с азотистой кислотой:

Используя объединенный газовый закон PV/T = const , рассчитаем объем азота при нормальных условиях (при температуре 0 °С, или 273 °К, и давлении 760 мм рт.ст.): V 0 (N 2) (н.у.) = (Р 1 ·V 1 ·T 0)/(P 0 ·T 1) = (748·2,01·273)/(760·293) = 1,84 мл.
Поскольку количества молей вещества
аминокислоты и выделяющегося газа N2 одинаковы,
составим пропорцию:
9,36 мг аминокислоты дает 1,84 мл N 2 ;
M (молекулярная масса аминокислоты) даст = 22,4 N 2 .
М = (9,36·22,4)/1,84 = 114.
Это может быть валин:
Задача 3. Гемоглобин животного содержит 0,335% железа (по массе). Какова минимальная молярная масса этого белка? Сколько атомов железа входит в состав молекулы, если определенная методом измерения осмотического давления молекулярная масса белка равна 67000?
Решение
Массовая доля железа в гемоглобине: С%(Fe) = /M(белка), где n – число атомов Fe в молекуле белка. Пусть n = 1, тогда М(белка)1 = M(Fe)·100%/C%(Fe) = 56·100/0,335 = 16700. Поскольку истинное значение (по условию) М(белка) ист. = 67000, n = М ист./М 1 = 67000/16700 = 4.
Задача 4. При щелочном гидролизе 48 г дипептида, состоящего из остатков одной и той же аминокислоты, образовалось только одно вещество – натриевая соль аминокислоты. Масса этой соли равна 66,6 г. Установите строение дипептида.
Решение
Уравнение реакции щелочного гидролиза дипептида:
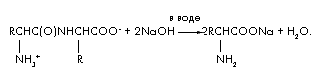
Обозначим количество дипептида в молях (дипептида) = х. Тогда в реакции гидролиза расходуется удвоенное количество щелочи (NaOH) = 2х и образуется (аминокислоты) = 2х и (H2O) = х. Составим уравнение материального баланса, используя формулу m = ·M;
m(дипептида) + m(NaOH) = m(соли аминокислоты)
+ m(H 2 O); 48 + 2х·40 = 66,6 + х·18; 62х = 18,6;
х = 0,3 моля. M(дипептида) = m/ = 48/0,3 = 160. M(аминокислоты) =
[М(дипептида) + M(H 2 O)]/2 = 178/2 = 89 г/моль.
Аминокислота – аланин. Строение дипептида:![]() .
.
I. По числу функциональных групп
Моноаминомонокарбоновые кислоты
простейший представитель:

Моноаминодикарбоновые кислоты

Например:

Диаминомонокарбоновые кислоты

Например:

II. По взаимному положению карбоксильной и аминогруппы
-α-аминокислоты

- β-аминокислоты

- γ-аминокислоты

Формулы и названия некоторых α-аминокислот, остатки которых входят в состав белков

Белки представляют собой природные полимеры, макромолекулы которых построены из большого числа остатков 20 различных α-аминокислот. В биохимии для аминокислот используют, как правило, короткие тривиальные названия и трехбуквенные обозначения.
Моноаминомонокарбоновые кислоты
|
Аминоэтановая, или аминоуксусная кислота, или глицин (гликокол) |
|
|
2-аминопропановая, или α-аминопропионовая кислота, или аланин |
|
|
2-амино-З-гидроксипропановая, или α-амино-β-гидроксипропионовая кислота, или серин |
|
|
2-амино-З-меркаптопропановая кислота, или β-меркаптоаланин, или цистеин |
|
|
2-амино-З-фенилпропановая кислота, или β-фенилаланин, или фенилаланин |
|
|
2-амино-3-(4-гидроксифенил)-пропановая кислота, или β-(n-гидроксифенип)-апанин, или тирозин |
|
|
2-амино-З-метилбутановая, или α-аминоизовалериановая кислота, или валин |
Моноаминодикарбоновые кислоты
Диаминомонокарбоновая кислота
Классификация природных аминокислот
I. Заменимые аминокислоты - могут синтезироваться в организме человека. К ним среди вышеперечисленных относятся: глицин, аланин, серин, цистеин, тирозин, аспарагиновая и глутаминовая кислоты.
II. Незаменимые аминокислоты - не могут синтезироваться в организме человека, должны поступать в организм в составе белков пищи. Фенилаланин, валин, лизин - представители незаменимых аминокислот.
Физические свойства
Большинство аминокислот - бесцветные кристаллические вещества, хорошо растворимые в воде. Многие аминокислоты имеют сладкий вкус. Температуры плавления разных аминокислот лежат в пределах 230-300°C.
Химические свойства
Аминокислоты являются амфотерными соединениями, что обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH 2) характера.
1. Взаимодействие с основаниями

2. Взаимодействие с кислотами

3. Образование внутренних солей (биполярных ионов)
В водных растворах аминокислоты существуют в виде равновесных смесей молекул и биполярных ионов, которые в кислой среде переходят в катионную форму, а в щелочной среде - в анионную форму.
а) Моноаминомонокарбоновые кислоты

При образовании внутренних солей моноаминомонокарбоновых кислот характер среды не изменяется. Поэтому эти аминокислоты называются нейтральными. Суммарный заряд внутренних солей таких кислот равен нулю.
При добавлении кислоты (Н +) карбоксилат-ион протонируется и остается только положительный заряд на группе -NH
б) Моноаминодикарбоновые кислоты

При образовании внутренних солей моноаминодикарбоновых кислот образуется избыток ионов водорода, поэтому водные растворы этих кислот имеют рН
в) Диаминомонокарбоновые кислоты

При образовании внутренних солей диаминомонокарбоновых кислот образуется избыток гидроксид-ионов, поэтому их водные растворы имеют рН > 7. Такие аминокислоты называются основными. Суммарный заряд внутренних солей основных аминокислот положительный.
4. Образование пептидов
При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются дипептиды:

При взаимодействии двух разных аминокислот образуется смесь четырех дипептидов; например:

Дипептид, присоединяя еще одну молекулу аминокислоты, может образовать трипептид. Аналогично из трипептида можно получить тетрапептид и т. д.
5. Образование производных по карбоксильной группе
Как и карбоновые кислоты, аминокислоты могут образовывать сложные эфиры, хлорангидриды и др. Например:

6. Поликонденсация ε-аминокапроновой кислоты

Способы получения
1. Аммонолиз α-галогенкарбоновых кислот
2. Гидролиз белков
Аминокислоты содержат амино - и карбоксильную группы и проявляют все свойства, характерные для соединений с такими функциональными группами. При написании реакций аминокислот пользуются формулами с неионизированными амино- и карбоксигруппами.
1)реакции по аминогруппе. Аминогруппа в аминокислотах проявляет обычные свойства аминов: амины являются основаниями, а в реакциях выступают в роли нуклеофилов.
1. Реакция аминокислот как основания. При взаимодействии аминокислоты с кислотами образуются аммонийные соли:
хлоргидрат глицина, хлороводородная соль глицина
2. Действие азотистой кислоты. При действии азотистой кислоты образуются гидроксикислоты и выделяется азот и вода:
Эту реакцию используют для количественного определения свободных аминных групп в аминокислотах, а также и в белках.
3.Образование N - ацильных производных, реакция ацилирования.
Аминокислоты реагируют с ангидридами и галогенангидридами кислот, образуя N - ацильные производные аминокислот:
Бензиловый эфир натриевая соль N карбобензоксиглицин - хлормуравьиной глицина
Ацилирование - один из способов защиты аминогруппы. N-ацильные производные имеют большое значение при синтезе пептидов, так как N-ацилпроизводные легко гидролизуются с образованием свободной аминогруппы.
4.Образование оснований Шиффа. При взаимодействии a - аминокислот с альдегидами образуются замещенные имины (основания Шиффа) через стадию образования карбиноламинов:
аланин формальдегид N-метилольное производное аланина
5.Реакция алкилирования. Амииногруппа в a -аминокислоте алкилируется с образованием N – алкилпроизводных:
Наибольшее значение имеет реакция с 2,4 - динитрофторбензолом. Получаемые динитрофенильные производные (ДНФ-производные) используются при установлении аминокислотной последовательности в пептидах и белках. Взаимодействие a- аминокислот с 2,4-динитрофторбензолом является примером реакции нуклеофильного замещения в бензольном ядре. За счет наличия в бензольном кольце двух сильных электроноакцепторных групп галоген становится подвижным и вступает в реакцию замещения:
 |
2,4 – динитро -
фторбензол N - 2,4 - динитрофенил - a - аминокислота
(ДНФБ) ДНФ - производные a - аминокислот
6.Реакция с фенилизотиоцианатом. Эта реакция широко используется при установлении строения пептидов. Фенилизотиоцианат является производным изотиоциановой кислоты H-N=C=S. Взаимодействие a - аминокислот с фенилизотиоцианатом протекает по механизму реакции нуклеофильного присоединения. В образовавшемся продукте далее осуществляется внутримолекулярная реакция замещения, приводящая к образованию циклического замещенного амида: фенилтиогидантоин.
Циклические соединения получаются с количественным выходом и представляют собой фенильные производные тиогидантоина (ФТГ - производные) - аминокислот. ФТГ - производные различаются строением радикала R.
Кроме обычных солей a- аминокислоты могут образовывать в определенных условиях внутрикомплексные соли с катионами тяжелых металлов. Для всех a - аминокислот очень характерны красиво кристаллизующиеся, интенсивно окрашенные в синий цвет внутрикомплексные (хелатные) соли меди):
Этиловый эфир аланина
Образование сложных эфиров - один из методов защиты карбоксильной группы в синтезе пептидов.
3.Образование галогенангидридов. При действии на a- аминокислоты с защищенной аминогруппой оксидихлоридом серы (тионилхлоридом) или оксид-трихлоридом фосфора (хлорокисью фосфора) образуются хлорангидриды:
Получение галогенангидридов - один из способов активации карбоксильной группы в пептидном синтезе.
4.Получение ангидридов a - аминокислот. Галогенангидриды обладают очень высокой реакционной способностью, что снижает селективность реакции при их использовании. Поэтому более часто используемый способ активации карбоксильной группы в синтезе пептидов - это превращение ее в ангидридную. Ангидриды по сравнению с галогенангидридами кислот обладают меньшей активностью. При взаимодействии a- аминокислоты, имеющей защищенную аминогруппу, с этиловым эфиром хлормуравьиной кислоты(этилхлорформиатом) образуется ангидридная связь:
5. Декарбоксилирование. a - Аминокислоты, имеющие две электроноакцепторные группы при одном и том же атоме углерода, легко декарбоксилируются. В лабораторных условиях это осуществляется при нагревании аминокислот с гидроксидом бария.Эта реакция протекает в организме при участии ферментов декарбоксилаз с образованием биогенных аминов:
нингидрин
Отношение аминокислот к нагреванию. При нагревании a- аминокислот образуются циклические амиды, называемые дикетопиперазинами:

Дикетопиперазин
g - и d - Аминокислоты легко отщепляют воду и циклизуются с образованием внутренних амидов, лактамов:
g - лактам (бутиролактам)
В тех случаях, когда амино - и карбоксильная группы разделены пятью и более углеродными атомами, при нагревании происходит поликонденсация с образованием полимерных полиамидных цепей с отщеплением молекулы воды.
Которая выполняет важные биологические функции в живых организмах, участвует в биосинтезе белка, отвечает за нормальную деятельность нервной системы и регулирует обменные процессы. Аминоуксусную кислоту, выведенную искусственным путем, используют в фармацевтике, медицине и пищевой промышленности.
Пищевая добавка Е640 объединяет под одним маркировочным номером аминоуксусную кислоту (глицин) и его натриевую соль – соединения, которые применяют для оптимизации вкуса и аромата продуктов. Добавка безопасна и официально разрешена в большинстве стран мира.
Глицин и его натриевая соль: общая информация
Глицин, известный также как аминоуксусная или аминоэтановая кислота, относится к ряду заменимых аминокислот – простейших органических структур, которые входят в состав белков и их соединений. Вещество, полученное искусственным путем, представляет собой бесцветный порошок без запаха и отличается сладковатым вкусом.
В промышленных масштабах глицин добывают путем соединения хлоруксусной кислоты и аммиака. Аминоуксусная кислота, в свою очередь, обладает свойством образовывать сложные соли (глицинаты) с ионами металлов.
Глицинат натрия – соль натрия и аминоуксусной кислоты, которая также является веществом синтетического происхождения. Несмотря на то, что глицин и его соль – разные химические соединения, в пищевой промышленности они выполняют идентичные функции модификаторов вкуса и аромата, объединены под одним маркировочным номером и рассматриваются как добавка Е640.
| Наименование | Глицин (Glycine) |
|---|---|
| Синонимы | Аминоуксусная (аминоэтановая) кислота, гликокол (устар.) |
| Группа | Заменимые аминокислоты |
| Химическая формула | NH 2 – CH 2 – COOH |
| Структура | Мелкие моноклинные кристаллы (кристаллообразный порошок) |
| Цвет | Белый (бесцветный) |
| Запах | Отсутствует |
| Вкус | Сладкий |
| Растворимость | Полностью растворим в , частично – в . Не растворяется в эфире |
| Код добавки | Е640 (включая натриевую соль) |
| Происхождение | Синтетическое |
| Токсичность | Безопасен при употреблении в пределах нормы |
| Области применения | Пищевая промышленность, фармацевтика, медицина, косметология |
Биологическая роль глицина и его источники
Глицин встречается в составе белковых молекул гораздо чаще остальных аминокислот и выполняет важнейшие биологические функции. В организме человека эта аминокислота синтезируется путем переаминирования (обратимого перенесения аминогруппы) глиоксилата или ферментативного расщепления холина и серина.
Аминоуксусная кислота является предшественницей порфиринов и пуринов, биосинтез которых происходит в живых клетках, однако биологическая роль этого соединения не ограничивается этими функциями. Глицин также является нейромедиатором, который участвует в передаче нервных импульсов, регулирует выработку других аминокислот и оказывает «тормозящее» воздействие на нейроны и мотонейроны.
Организм здорового человека самостоятельно синтезирует аминокислоты в необходимых количествах, поэтому необходимость в их употреблении в составе лекарственных средств и биологически активных добавок, как правило, отсутствует. Пищевыми источниками аминоуксусной кислоты являются продукты животного происхождения (говяжья печень и ), орехи и некоторые фрукты.
Влияние глицина и его натриевой соли на организм человека
Аминоуксусная кислота как нейромедиатор выполняет регуляторные функции и влияет в первую очередь на центральную и периферийную нервную систему. Глицин обладает ноотропными свойствами, нормализует обмен веществ, активизирует защитные функции ЦНС и оказывает мягкое успокаивающее действие.
Положительное влияние глицина на организм человека:
- снижение эмоционального напряжения, тревожности, стресса, агрессивности;
- улучшение настроения и нормализация сна;
- расслабление мышц и снятие судорог;
- повышение работоспособности;
- ослабление побочных эффектов приема психотропных препаратов;
- уменьшение выраженности вегетососудистых расстройств;
- снижение тяги к алкоголю и сладкому.
В составе добавки Е640 глицин и его соль не обладают вышеуказанными свойствами и не оказывают ни положительного, ни отрицательного воздействия на организм человека при употреблении в пределах нормы. Пищевая добавка не представляет угрозы здоровью, но в случае индивидуальной непереносимости может спровоцировать аллергическую реакцию.
Потенциальную опасность могут представлять примеси в составе добавки и некачественные продукты питания, при изготовлении которых применяются оптимизаторы вкуса и аромата.
Применение глицина и его натриевой соли
Области применения глицина и глицината натрия ограничиваются в основном пищевой промышленностью, медициной и фармацевтикой. Тем не менее, аминоуксусная кислота нашла применение и в косметической отрасли благодаря гипоаллергенности и антиоксидантному действию.
Косметические средства, содержащие добавку Е640:
- лечебные шампуни для ослабленных волос и средства против облысения;
- антивозрастная косметика, увлажняющие кремы и маски для всех типов кожи;
- очищающие сыворотки и тоники;
- губные помады и бальзамы.
Измельченные таблетки глицина можно использовать при изготовлении домашних средств для ухода за кожей, добавлять в увлажняющие маски и кремы. Аминоуксусная кислота способствует проникновению ценных питательных компонентов в глубокие слои дермы и усиливает эффект лечебной косметики.
Добавка Е640 в пищевой промышленности
 Глицин и глицинат натрия активно используются в технологических процессах изготовления ликероводочных напитков. Добавка Е640 в частности входит в состав элитной водки, что позволяет нейтрализовать неприятный запах и смягчить резкий вкус. Существует также мнение, что присутствие глицина в спиртных напитках помогает снизить токсическое действие алкоголя на нервную систему и предотвращает похмелье.
Глицин и глицинат натрия активно используются в технологических процессах изготовления ликероводочных напитков. Добавка Е640 в частности входит в состав элитной водки, что позволяет нейтрализовать неприятный запах и смягчить резкий вкус. Существует также мнение, что присутствие глицина в спиртных напитках помогает снизить токсическое действие алкоголя на нервную систему и предотвращает похмелье.
Продукты питания, в составе которых можно встретить добавку Е640:
- крепкие алкогольные напитки;
- джемы, варенья, желе, ;
- пакетированные соки с мякотью;
- обогащенная поваренная ;
- спортивные витаминизированные напитки;
- соусы, приправы и пряности.
Аминоуксусная кислота применяется не только для оптимизации вкусовых качеств и транспортировки биологически активных веществ, но и в качестве антибактериального средства. В частности, ею обрабатывают мясо, рыбу и морепродукты для обезвреживания опасной кишечной палочки.
Использование в медицинских целях
Глицин активно применяется для лечения и профилактики заболеваний, связанных с центральной и периферийной нервной системой. Это вещество входит в состав фармацевтических препаратов ноотропного, седативного, противосудорожного и снотворного действия, обладает слабо выраженным антидепрессивным и транквилизирующим эффектом.
Медицинские показания к применению аминоуксусной кислоты как лекарственного средства:
- сниженная умственная работоспособность, нарушения сна и памяти;
- эмоциональное напряжение, стрессовые ситуации, неврозы;
- эмоциональная нестабильность и повышенная возбудимость;
- последствия ишемического инсульта, черепно-мозговых травм и нейроинфекций;
- вегетососудистая дистония, ишемия;
- повышенный мышечный тонус, мышечные судороги;
- алкогольная и наркотическая зависимость, токсическое действие препаратов, угнетающих ЦНС.
Доказано, что употребление 3 г глицина в сутки положительно влияет на умственные способности и общее эмоциональное состояние человека, снимает сонливость в дневное время и нормализует ночной сон. Препарат также назначают беременным для снижения тревожности, детям и подросткам, которые испытывают трудности с социальной адаптацией и концентрацией внимания.
Добавка Е640 и законодательство
Оптимизатор вкуса и запаха Е640 применяют при производстве продуктов питания в большинстве стран мира, однако информация о добавке в Кодекс Алиментариус отсутствует. Случаев отравления глицином и глицинатом натрия при употреблении в пищу зарегистрировано не было, поэтому модификатор Е640 считается безопасным.
Добавка входит в список официально разрешенных к использованию в пищевой промышленности на территории Евросоюза, США и Канады. Законодательство Российской Федерации и Беларуси также допускает наличие Е640 в продуктах в пределах допустимых норм, установленных СанПиН. Данных об использовании Е640 как усилителя вкуса и ароматизатора на территории Украины нет.
Несмотря на то, что глицин и его соль не оказывают токсического влияния на организм человека и разрешены к использованию, продукты, в составе которых присутствует Е640, сложно назвать полезными. Большинство вкусовых добавок и ароматизаторов используется для привлечения внимания покупателя к продукции низкого качества, употребление которой следует свести к минимуму.